
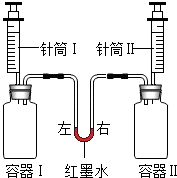
| 实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ | 红墨水液面位置 |
| a | 生石灰 | 10mL水 | NaCl | 10mL水 | 保持左低右高 |
| b | 二氧化碳(充满) | 10mL澄清石灰水 | 二氧化碳(充满) | 10mL浓氢氧化钠溶液 | |
| c | 1g铝 | 15mL盐酸 | 1g镁 | 15mL盐酸 |
分析 根据装置的气密性检查分析解答;根据氢氧化钙和氢氧化钠两种溶液与二氧化碳气体反应的程度来分析;根据产生气体的多少来分析.
解答 解:(1)此操作检查装置的气密性,说明装置气密性良好;
(2)二氧化碳能和氢氧化钠溶液反应,并且反应比二氧化碳和石灰水反应更彻底,造成容器Ⅱ内的压强小于容器Ⅰ中的压强,会看到红墨水液面左低右高,并且石灰水变浑浊;
(3)根据两种金属与盐酸反应的化学方程式进行比较:
3Al+6HCl=2AlCl3+3H2↑
54 6
Mg+2HCl=MgCl2+H2↑
24 2
可见,产生相同质量的氢气,需要的铝的质量比镁小,故各1g铝和镁与足量的盐酸反应产生的氢气,铝多余镁,故容器Ⅱ中的气体压强小于于容器Ⅰ中的气体压强.
故答案为:(1)装置气密性良好;
(2)容器Ⅰ中石灰水变浑浊,红墨水左低右高;
(3)左低右高;等质量的镁、铝与足量盐酸反应,铝生成的氢气多,容器Ⅱ比容器Ⅰ的压强小.
点评 物质的性质可以通过实验现象表现出来,实验现象可以反映物质的性质,因此要学会观察、分析实验,为揭示物质的性质奠定基础.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气用于发射火箭,是利用氧气的助燃性 | |
| B. | 氦气用来充灌探空气球,主要是利用氦气化学性质稳定 | |
| C. | 稀有气体充入霓虹灯,是利用稀有气体通电能发出不同颜色的光 | |
| D. | 二氧化碳用于灭火,是利用它的物理性质和化学性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间 | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中有气泡产生. | 此过程中发生反应的化学方程式为Na2CO3+2HCl=H2O+CO2↑+2NaCl |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钙溶液. | 实验过程中产生 白色沉淀. | 则证明猜想Ⅱ或Ⅲ成立.此过程中发生反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KCl溶液 | B. | Ba(OH)2溶液 | C. | NaOH溶液 | D. | NaNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com