
【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,诺贝尔同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)上表中x的数值为_____。
(2)求原固体混合物样品中硫酸镁的质量分数。(写出计算过程)
(3)恰好完全反应时,溶液中溶质的质量分数为_____(结果精确到0.1%);若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由:_____。
【答案】(1)5.8;(2)90%;(3)12.5%;不可行,氢氧化钡也会与杂质硫酸钠反应,影响测定结果
【解析】
(1)根据表中的第1~3次数据可知,第1次加入氢氧化钠溶液25 g生成沉淀2.9 g,第3次加入氢氧化钠溶液75 g生成沉淀8.7 g,则第2次加入氢氧化钠溶液50 g生成沉淀5.8 g。
(2)解:设混合物样品中硫酸镁的质量分数为x。
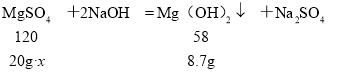
![]() , 解得:x=90%
, 解得:x=90%
(3)第3次加入75 g氢氧化钠溶液时,硫酸镁与氢氧化钠溶液恰好完全反应,设生成硫酸钠的质量为y。
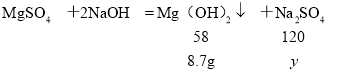
![]() ,解得:y=21.3 g
,解得:y=21.3 g
样品混合物中MgSO4的质量为20 g×90%=18 g
样品混合物中Na2SO4的质量为20 g-18 g=2 g
恰好安全反应时,溶液中Na2SO4的质量=21.3 g+2 g=23.3 g
恰好安全反应时,溶液中Na2SO4的质量分数=![]() ×100%≈12.5%。
×100%≈12.5%。
若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,不可行,因为氢氧化钡也会与杂质硫酸钠反应产生硫酸钡沉淀,影响测定结果。


科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见物质。单质A在空气中因“生锈”而使得表面变绿,绿色物质的主要成分与B反应生成C,C常用于配制农药波尔多液。D与常温下呈液体的E反应只生成F,F与纯碱溶液反应生成G和H,H高温煅烧生成D。
(1)A的化学式为_________________。
(2)D俗称为________________,D变成F的过程是________________ (填“放热”或“吸热”)过程,F在日常生活的一种用途为________________。
(3) C与F反应的化学方程式为________________,其基本反应类型为________________。
(4) F与纯碱反应的化学方程式为________________,G的物质类别属于________________ (填 “酸”或“碱”或“盐”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质。富玛克斯法治理硫化氢的方法和步骤如下:
①用 2%~3%的 Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为 NaHS;
②再加入一种 RNO(液)(R 表示一种有机基团)与生成的这种酸式盐(NaHS)的水溶液反应生成硫、碱和 RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH 与空气中的氧发生反应又得到 RNO。
(1)写出上述有关反应的化学方程式。
① _________;
③______________;
(2)富玛克斯法的总反应的化学方程式为:__________ ,RNO 在整个过程中起到_________的作用。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。回答下列问题:
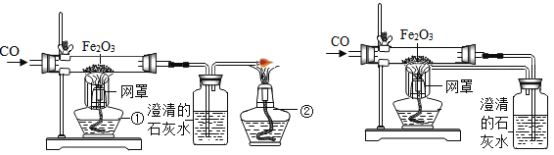
(1)写出用一氧化碳还原氧化铁的化学反应方程式:_____。
(2)实验中澄清石灰水作用是_____。
(3)图甲中第①个酒精灯上网罩的作用是_____。实验时应先点燃第_____个酒精灯。
(4)图乙与图甲相比,它的主要优点是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应变化关系的是( )
A.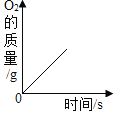 加热一定质量KClO3和MnO2的混合物
加热一定质量KClO3和MnO2的混合物
B. 向含有稀盐酸和氯化铜的混合溶液中滴加NaOH溶液
向含有稀盐酸和氯化铜的混合溶液中滴加NaOH溶液
C. 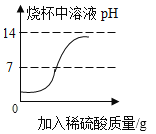 向盛有一定质量的NaOH溶液的烧杯中逐滴滴加稀硫酸至过量
向盛有一定质量的NaOH溶液的烧杯中逐滴滴加稀硫酸至过量
D.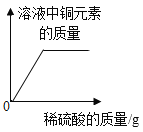 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、KOH、CaCO3和CuCl2,中的一种,其中,甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
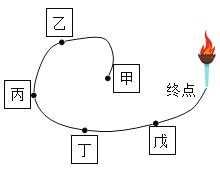
(1)甲能分别与另四种物质中的___________、____________反应(写化学式)。
(2)丁与戊反应的化学方程式为____________。
(3)丙与丁反应的化学方程式为_________。属于_________(填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物x的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X是__________(写一种),其发生反应的化学方程式为__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用。
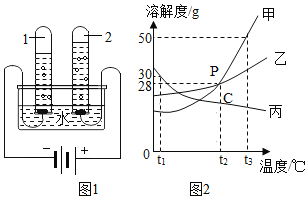
(1)近日,浙江大学研制出世界上最轻的材料“碳海绵”,它被预测可代替活性炭用于净水,说明它有较强的_____性。
(2)如图1实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为_____mL。
(3)欲使图2中乙溶液的状态从P点转化为C点,可采取的措施是_____。
(4)图2,t2℃时,把56g乙物质加入到200水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(5)图2中,将150g甲的饱和溶液从t3℃降到t2℃后,向其中加入50g水,此时所得溶液的溶质质量分数是_____(计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】普通自来水中加入一定量的氯化钠(NaCl),利用图1所示装置电解,从电解槽阳极流出的溶液pH<2.7,氧化电位(ORP)>1000mV,同时含有HClO、O3、H2O2等氧化剂,称为酸性氧化电位水(英文缩写EOW),具有较强的杀菌消毒作用。在紫外线照射并长期放置后,其氧化性逐渐降低,最终变为普水,是一种绿色消毒剂。

研究实验溶液的浓度、电解电压和时间等条件对EOW的组分、性能的影响,部分实验数据如图2所示的。
对EOW的杀菌机理进行研究,得到以下实验结果:
①与pH=2.6的盐酸相比,pH=2.6的EOW杀菌效率高很多倍。
②EOW中含有的HClO是活性氯消毒剂(如次氯酸钠)的有效成分。用盐酸和次氯酸钠配制出与EOW的pH、ORP和有效率含量相同的溶液,与EOW进行对照。杀灭同类细菌,EOW用时30s,次氯酸钠溶液需要3~5 min。
③EOW制备过程中产生的H2O2、O3等活性氧成分具有杀菌作用,活性氧不稳定。实验表明,保存三个月EOW 仍有杀菌作用。
EOW有杀菌强效、持续、广谱、不残留、无二次污染等优点,不仅被广泛应用,而且成为目前杀菌消毒领域的研究热点。
依据文章内容回答下列问题:
(1)在EOW所含有的成分中,属于氧化物的是__________。
(2)“EOW最终会变为普通水。”其变化过程中包含过氧化氢的分解,反应的化学方程式为__________。
(3)对EOW的制备条件进行的研究中,A点食盐溶液浓度是2.6g/L的,你对它的理解是__________。
(4)在研究电解时间对EOW的pH影响的五组实验中,应控制的变量有__________。
(5)下列说法正确的是__________。
A 因为阳极水的pH <7所以称为酸性水 B HClO中氯元素的化合价为1
C EOW具有杀菌作用是因为含有HClO D EOW可用于食品消毒
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图 1 是元素周期表中的一部分,图 2 是溴原子的结构示意图。据图回答问题:
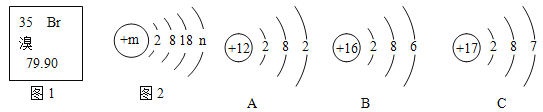
(1)图 2 中 n 的值为 ___________________;
(2)若 B 原子得到 2 个电子形成离子,则其对应的化学符号为 ___________________;
(3)写出溴和 A 形成化合物的化学式 ___________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com