
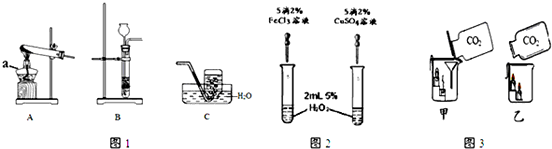
 2H2O+O2↑
2H2O+O2↑ 

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后 加入过氧化氢溶液 加入过氧化氢溶液 观察现象 |
溶液依然为红色 | 不是生成的过氧化氢使溶液褪色 不是生成的过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
取少量原溶液于试管中,加入适量水,观察现象 取少量原溶液于试管中,加入适量水,观察现象 |
(1)变回红色 (2)依然无色 (1)变回红色 (2)依然无色 |
(1)氢氧化钠溶液浓度过大导致溶液颜色褪去 (2)溶液颜色褪去与氢氧化钠溶液浓度无关 (1)氢氧化钠溶液浓度过大导致溶液颜色褪去 (2)溶液颜色褪去与氢氧化钠溶液浓度无关 |
查看答案和解析>>
科目:初中化学 来源: 题型:
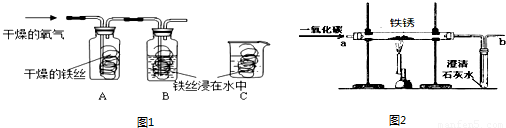
铁是容易生锈的金属,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%.
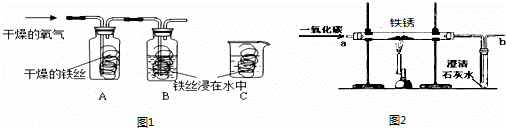
(1)同学们用图1所示装置探究铁生锈的条件,将干燥的氧气通入A、B瓶内,大约经4~5min,A处的铁丝依然光亮,而B处的铁丝表面变暗,C中铁丝依然光亮.A、B进行对比,现象不同,说明铁生锈与 有关.B、C处的现象对比说明,决定铁生锈快慢的一个重要因素是 .
(2)下列方法不能除去铁制品表面铁锈的是
A.用氢氧化钠溶液浸泡 B.用稀盐酸浸泡 C.用砂纸打磨 D.用厕所清洁剂(pH=1)洗
(3)请你列举一种防止铁生锈的措施 .
(4)实验室内将铁锈再生为铁,可利用图2所示装置,请回答:
①实验前应该先通入CO,后加热,其目的是 .
②在装置b处再放置一盏燃着的酒精灯,其目的是 .
③铁锈的主要成分氧化铁再生为铁的化学方程式为 .
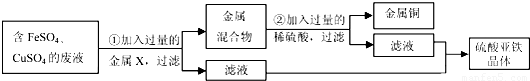
(5)学校实验室从校办厂拉回一桶含有FeSO4、CuSO4的废液,同学们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

步骤①中,金属X是 ,步骤②中,加入过量稀硫酸的目的是 ,证明步骤②中硫酸已过量的以下方法合理的是
A.加入硫酸后,立即测出溶液的pH小于7
B.充分反应后,取少量溶液加铁时有气泡产生
C.充分反应后,取少量溶液滴加氯化钡溶液时有沉淀产生.
查看答案和解析>>
科目:初中化学 来源:2013年江苏省盐城市东台实验中学中考化学模拟试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com