
【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
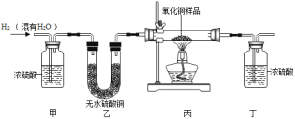
(1)实验中,乙装置的作用是______。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.4克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度___(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是______。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收
【答案】检验氢气中混有的水是否全部被浓硫酸吸收 80% B
【解析】
(1)实验中,乙装置的作用是:检验氢气中混有的水是否全部被浓硫酸吸收;
(2)设参加反应的氧化铜的质量为x。
根据浓硫酸增加的质量可知,生成的水的量为:163.9g-161.2g=2.7g,

![]()
x=12g
氧化铜的纯度为:![]() ×100%=80%
×100%=80%
答:氧化铜的纯度为80%。
(3)A.装置的气密性不好,导致计算的水的质量偏小,从而导致氧化铜的质量分数偏小,选项错误;
B.空气中的水分被丁处浓硫酸吸收,导致计算的水的质量偏大,从而导致计算的氧化铜质量分数偏大,选项正确;
C.通入的氢气量不足,导致水的质量偏小,从而导致氧化铜的质量分数偏小,选项错误;
D.空气中的二氧化碳不能被丁处浓硫酸吸收,不影响结果,选项错误。
故填:B。


科目:初中化学 来源: 题型:
【题目】下列是实验室制备气体装置。
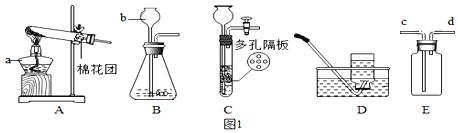
(1)仪器b名称______。
(2)实验室用高锰酸钾制取一瓶纯净的氧气的发生装置选______,化学方程式______。
(3)实验室用C装置制取CO2,该装置与B相比,优点是______,化学方程式______。
(4)用E装置收集H2,H2从______导管进。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中常见的8种物质,它们有如下图所示的转化关系。已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。

(1)请写出下列物质的化学式: D_______,E_________,G_______,H______。
(2)请写出下列变化的化学方程式:
①B→F_______________________________________,
②C→B________________________________________,
③B→G________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】气体制取和性质是初中化学知识的核心之一。如图是实验室制取气体的常用装置。请根据题意回答问题:

![]() 写出图中标有数字的仪器名称:①______;②______。
写出图中标有数字的仪器名称:①______;②______。
![]() 实验室用双氧水和二氧化锰制取氧气的发生装置应选用______
实验室用双氧水和二氧化锰制取氧气的发生装置应选用______![]() 填标号,下同
填标号,下同![]() ,写出该反应的化学方程式______。
,写出该反应的化学方程式______。
![]() 若要收集较为纯净的氧气最好选用______作为收集装置。
若要收集较为纯净的氧气最好选用______作为收集装置。
![]() 是一种多功能装置,可用于集气、洗气等,若将F装置内装满水,再连接量筒,就可以用于测定不溶于水且不与水反应的气体体积,则气体应从______
是一种多功能装置,可用于集气、洗气等,若将F装置内装满水,再连接量筒,就可以用于测定不溶于水且不与水反应的气体体积,则气体应从______![]() 填“a”或“b”
填“a”或“b”![]() 进入。
进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请按要求用符号完成下面问题(答案不唯一的小题,务必写全):
(1)硫酸铁中硫元素的化合价 _____;(2)硫酸铵中的原子团____;
(3)氯化钙溶液中的微粒___ ; (4)由相同的两种原子所形成的两种不同离子____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量 /g | m | 58.4 | 82.6 | 107.6 |
求:(1)生成二氧化碳的总质量是_____g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是_____g。
(3)该石灰石样品中碳酸钙的质量分数为________。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )

A. 甲的溶解度比乙大
B. t2℃时,甲、乙的饱和溶液中溶质的质量相等
C. t1℃时,在50g水中加入15g甲,可得到 65g 溶液
D. 要使接近饱和的甲溶液转化为饱和溶液,可采用降温的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
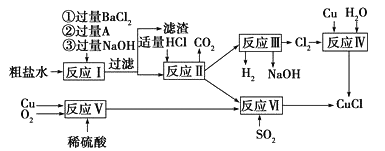
⑴A溶液中溶质的化学式是______________;
⑵写出反应III的化学方程式_________;
⑶反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是____;
⑷本工艺中可循环利用的物质是_______________;
⑸反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。70℃真空干燥的目的是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像与对应的表述一致的是( )
A. 加热氯酸钾和二氧化锰的混合物
B. 向一定量硫酸铜溶液中不断加入锌粉,溶液的质量变化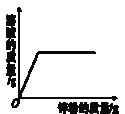
C. 向一定量的稀盐酸和氯化钙的混合溶液中不断加入碳酸钠溶液至过量
D. 向稀硫酸中加水,溶液pH的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com