
分析 根据单质(金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字)和化合物(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)化学式的书写方法进行分析解答即可.
解答 解:(1)硫化钠中钠元素显+1价,硫元素显-2价,其化学式为Na2S.
(2)氖气属于稀有气体单质,直接用元素符号表示其化学式,其化学式为Ne.
(3)氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3.
(4)硫酸亚铁中铁元素显+2价,硫酸根显-2价,其化学式为:FeSO4.
故答案为:(1)Na2S;(2)Ne;(3)Al2O3;(4)FeSO4.
点评 本题难度不大,掌握单质(用元素符号或元素符号的右下角写上表示分子中所含原子数的数字)和化合物化学式的书写方法(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)是正确解答此类题的关键.


科目:初中化学 来源: 题型:解答题
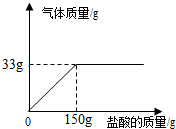 化学研究小组为测定某石灰石样品中碳酸钙的质量分数,取100g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:
化学研究小组为测定某石灰石样品中碳酸钙的质量分数,取100g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出20g溶液,加入足量的锌粒.充分反应后,产生的氢气为0.02g.
有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出20g溶液,加入足量的锌粒.充分反应后,产生的氢气为0.02g.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”和“
”和“ ”分别代表不同种类的原子,请仔细观察图示回
”分别代表不同种类的原子,请仔细观察图示回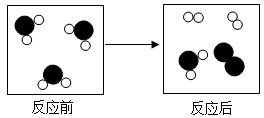
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水是一种氧化物 | B. | 煮沸水可以降低水的硬度 | ||
| C. | 水由氢分子和氧分子构成 | D. | 电解水时在负极得到氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
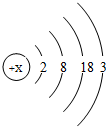 阅读材料,回答问题:
阅读材料,回答问题:| 13 Al 铝 26.98 | 14 Si 硅 28.09 |
| 类铝 | 类硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com