
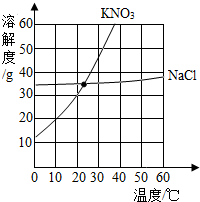
 根据如图硝酸钾和氯化钠的溶解度曲线,有关叙述正确的是( )
根据如图硝酸钾和氯化钠的溶解度曲线,有关叙述正确的是( )

科目:初中化学 来源: 题型:
 28、如图为氯化钠和硝酸钾固体的溶解度曲线.
28、如图为氯化钠和硝酸钾固体的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
(2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:| 试管编号 | 加入液体 | 加入物质 | 现象 |
| 1 | 10mL水 | 少量食盐 | 不溶 |
| 2 | 10mL乙醇 | 少量食盐 | 溶解 |
| 3 | 10mL水 | 几小粒碘 | 不溶 |
| 4 | 10mL乙醇 | 几小粒碘 | 溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:
如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:单选题
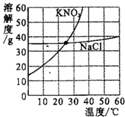 根据如图硝酸钾和氯化钠的溶解度曲线,有关叙述正确的是
根据如图硝酸钾和氯化钠的溶解度曲线,有关叙述正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com