
某校兴趣小组对氢氧化钠溶液与稀盐酸混合后的有关问题,进行了如下探究,请同学们一起参与此次探究之旅.
(1)探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
[方案设计]小亮、小丽、小林三位同学设计了如下方案进行探究:
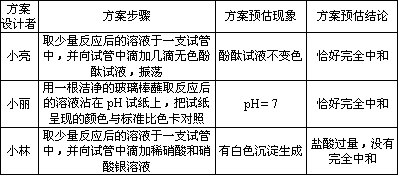
[方案评价]请判断以上设计的三个方案中,________同学的方案是正确的.
[方案反思]请分析另外两个方案错误的原因:________;________.
(2)探究二:氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
[作出猜想1 小亮猜想:溶质有NaCl、HCl、NaOH
小丽猜想:溶质只有NaCl
小林猜想:溶质有NaCl、HCl
你的猜想:溶质有________(填化学式)
小丽认为小亮的猜想是错误的,她的理由是________.
[实验设计及验证]请你将下列实验报告填写完整:

科目:初中化学 来源: 题型:阅读理解
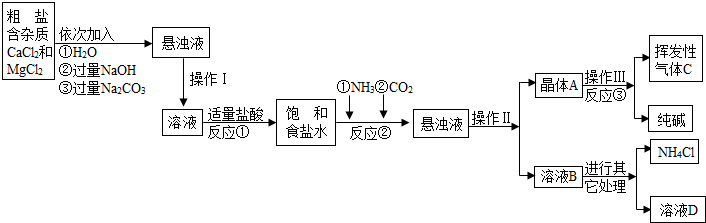
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
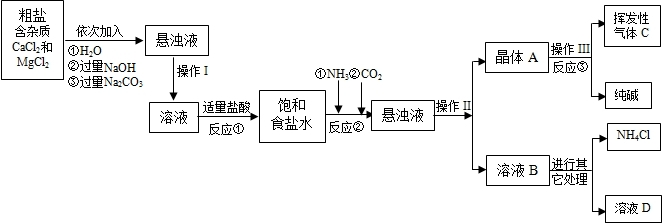
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
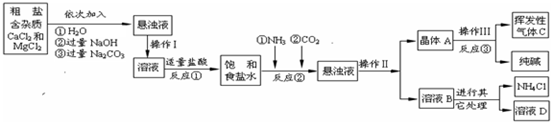
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化学 来源:江苏中考真题 题型:实验题
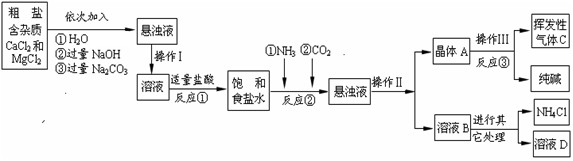
 NH3↑+HCl↑
NH3↑+HCl↑

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com