


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
取少量粉末于试管中,加水溶解,静置, 向试管中滴加无色酚酞试液 (或取少量粉末于试管中,加水溶解,静置, 取上层清液,加入适量的碳酸溶液) 取少量粉末于试管中,加水溶解,静置, 向试管中滴加无色酚酞试液 (或取少量粉末于试管中,加水溶解,静置, 取上层清液,加入适量的碳酸溶液) | 无色酚酞变红色 (或有白色沉淀产生) 无色酚酞变红色 (或有白色沉淀产生) | 这瓶氢氧化钙 粉末部分变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.| 实验步骤 | 实验现象 | 结论 |
| ①取样,加足量的水 | 固体完全溶解 | 没有不溶性杂质 没有不溶性杂质 |
| ②用试管取上述试液,加入过量,塞上带导管的单孔塞;将导管的另一端插入盛有 澄清石灰水的 澄清石灰水的 烧杯中 |
澄清石灰水变浑浊 澄清石灰水变浑浊 |
原固体混合物中含有 |
| ③再向试管中加入 | 有白色沉淀生成 | 原固体烧碱中含有 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?高安市二模)某兴趣小组走进实验室看到了一个不和谐的“音符”(如图).
(2012?高安市二模)某兴趣小组走进实验室看到了一个不和谐的“音符”(如图).查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤及操作方法 | 预期的实验现象 | 结论 |
| 取少量过氧化钙放入试管中,加足量水,振荡, 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) . |
清液变浑浊(或变为红色) 清液变浑浊(或变为红色) |
有氢氧化钙产生 |
| 实验的装置 | 实验的主要过程 |
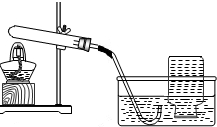 |
a.检查装置的气密性.操作如下:先 将导气管放入水中 将导气管放入水中 ,再用手紧握试管, 观察到 水中出现气泡 水中出现气泡 ,把手松开,导气管口形成一小段水柱;b.向试管中加入CaO2,连接并固定好装置,加热; c.收集一瓶气体.能用图中所示方法收集氧气的原因是 氧气不易溶于水 氧气不易溶于水 ;d.停止加热.停止加热前应先 将导气管从水中取出 将导气管从水中取出 ;e.检验气体.检验的方法是 将带火星的小木条伸入集气瓶中 将带火星的小木条伸入集气瓶中 . |
| 实验的装置 | 实验的主要过程 |
 |
a.检查装置的气密性. b.向试管中加入CaO2和水后,有少量细小气泡缓缓放出,在导气管口几乎收集不到气体.该装置放置到第二天,集气瓶中才收集到极少量的气体,振荡试管后仍然有少量的气泡不断缓缓放出. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com