
| A.Na+和Cl- | B.Cu2+和NO3- | C.K+和SO42- | D.Ba2+和NO3- |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:初中化学 来源: 题型:阅读理解
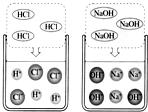 24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.
24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. |
没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. |
有 白色沉淀 生成,滤液为蓝色 |
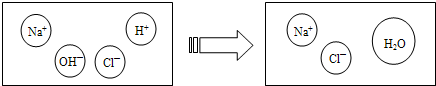
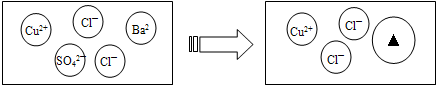
查看答案和解析>>
科目:初中化学 来源: 题型:
 29、在宏观、微观、符号之间建立联系,是化学学科特有的思维方式.
29、在宏观、微观、符号之间建立联系,是化学学科特有的思维方式.| 阳离子 阴离子 |
Na+ | K+ | Ba2+ |
| OH- | 溶 | 溶 | 溶 |
| SO42- | 溶 | 溶 | 不 |
| CO32- | 溶 | 溶 | 不 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验步骤及操作方法 | 实验现象 | 结 论 |
| a、向装有滤液的烧杯中滴加 硝酸银溶液 |
有白色沉淀产生 有白色沉淀产生 |
假设③成立 |
| b、过滤后,向白色沉淀中加入足量的 稀硝酸 稀硝酸 . |
白色沉淀部分溶解,且有 气泡 气泡 产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com