
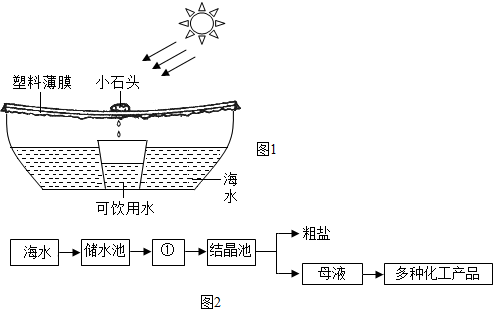
分析 用途一:溶液稀释前后,溶质质量不变;
用途二:蒸发海水时,随着水的蒸发,氯化钠质量分数越来越大,当达到饱和状态时,继续蒸发时会析出氯化钠固体;
“母液”的成分中,大量含有的阳离子有钙离子、镁离子和钠离子;
A.得到的粗盐中含有泥沙等物质,因此粗盐属于混合物;
B.在①中,随着水的蒸发,海水中水的质量逐渐减少;
C.在①中,一段时间内,海水中氯化钠的质量不变,当达到饱和状态时,继续蒸发时会析出氯化钠固体,海水中的氯化钠质量逐渐减小;
D.海水进入储水池,海水的成分基本不变.
解答 解:用途一:设蒸发水的质量为x,
根据题意有:2000g×3%=(2000g-x)×4%,
x=500g,
则收集到的可饮用水为500g.
故填:500.
用途二:(1)图中①是蒸发池.
故填:蒸发.
(2)“母液”的成分中,大量含有的阳离子是Ca2+、Mg2+、Na+.
故填:Ca2+、Mg2+、Na+.
(3)A.得到的粗盐中含有泥沙等物质,因此粗盐属于混合物,该选项说法不正确;
B.在①中,随着水的蒸发,海水中水的质量逐渐减少,该选项说法正确;
C.在①中,一段时间内,海水中氯化钠的质量不变,当达到饱和状态时,继续蒸发时会析出氯化钠固体,海水中的氯化钠质量逐渐减小,该选项说法不正确;
D.海水进入储水池,海水的成分基本不变,该选项说法正确.
故填:AC.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:填空题
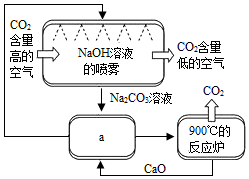 空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.
空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.查看答案和解析>>
科目:初中化学 来源: 题型:计算题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | $\frac{12}{30克}$=$\frac{x}{44}$ | B. | $\frac{12}{44}$=$\frac{30克}{x}$ | C. | $\frac{12}{x}$=$\frac{30克}{44}$ | D. | $\frac{12}{x}$=$\frac{44}{30克}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
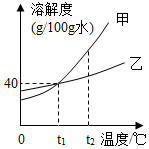 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )| A. | t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体 | |
| B. | t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g | |
| C. | 将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 | |
| D. | 将t2℃等质量的甲、乙饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com