
| A. | Na2S | B. | Na2SO3 | C. | Na | D. | NaOH |
分析 根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变,由此可推断化学反应方程式中反应物或生成物的化学式.
解答 解:从反应的化学方程式2Na2O2+2NaHSO4$\frac{\underline{\;\;△\;\;}}{\;}$2Na2SO4+2X+O2↑可以知道,反应后除2X外有4个钠原子、2个硫原子、10个氧原子,而反应前有6个钠原子、2个硫原子、12个氧原子和2个氢原子,根据反应前后原子的种类和数目都不变可知,2X中含有2个钠原子、2个氧原子和2个氢原子,因此X化学式为NaOH.
故选D.
点评 本题考查化学式的推断,利用原子守恒的方法即可推出物质的化学式,学生应明确质量守恒定律在利用化学反应推断物质化学式的重要作用.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
| 实验 | a中试剂 | b中试剂 | c中试剂 | 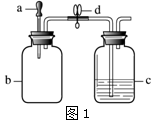 | 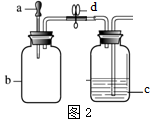 |
| I | 5%H2O2溶液 | MnO2 | 80℃热水 | ||
| II | 石蕊溶液 | HCl气体 | NaOH溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
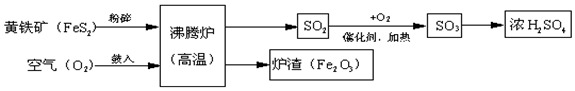
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事 实 | 解释 | |
| A | 书写档案规定必须使用碳素墨水 | 常温下碳的化学性质稳定 |
| B | 石墨能够做电池的电极材料 | 石墨能够导电 |
| C | 焦炭可以把铁从它的氧化物矿石里还原出来 | 焦炭具有氧化性 |
| D | 制糖工业中用活性炭来脱色以制白糖 | 活性炭具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
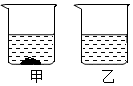 根据下表回答问题.
根据下表回答问题.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度 | A | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
| B | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 明矾可促进水中悬浮杂质的沉降 | |
| B. | 生活中常用蒸馏的方法降低水的硬度 | |
| C. | 地球上总水储量很大,水资源不会短缺 | |
| D. | 经自来水厂净化处理过的生活用水一定是软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com