
| A、Na2CO3、BaCl2、NaOH、HCl |
| B、BaCl2、Na2CO3、NaOH、HCl |
| C、BaCl2、Na2CO3、HCl、NaOH |
| D、BaCl2、NaOH、Na2CO3、HCl |


科目:初中化学 来源: 题型:
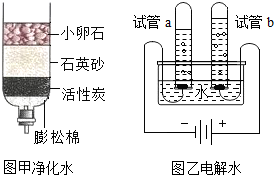 水是宝贵的自然资源.
水是宝贵的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:
 在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.下列符合①代表的反应的化学方程式是( )
在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.下列符合①代表的反应的化学方程式是( )| A、CuO+H2SO4═CuSO4+H2O | ||||
| B、Fe+CuCl2═FeCl2+Cu | ||||
| C、CaO+H2O═Ca(OH)2 | ||||
D、Mg(OH)2
|
查看答案和解析>>
科目:初中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 除杂所用的试剂和方法 |
| A | H2 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| B | NaOH溶液 | Ba(OH)2溶液 | 加入适量的K2SO4溶液,过滤 |
| C | CO气体 | CO2气体 | 通过灼热的CuO |
| D | Cu(OH)2固体 | CuCl2 | 加入适量的稀盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
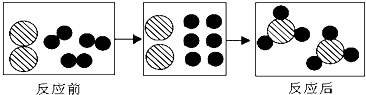
| A、反应前后分子种类不发生改变 |
| B、该反应的基本类型是化合反应 |
| C、参加反应的两种分子的个数比是1:3 |
| D、反应前后原子的种类与数目发生改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 物质 | 杂质(少量) | 试剂和操作方法 |
| A | FeSO4溶液 | CuSO4溶液 | 加入足量铁粉,过滤 |
| B | NaCl溶液 | Na2CO3溶液 | 加入适量氯化钡溶液,过滤 |
| C | Fe粉 | Cu粉 | 加入足量稀硫酸,过滤 |
| D | CaCl2溶液 | 盐酸 | 加入足量石灰水,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
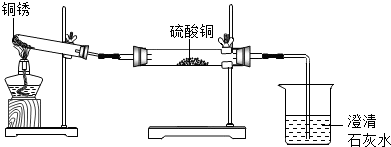
| 实验操作 | 实验现象 | 实验结论 |
| ①按上图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 |
| ③冷却后,向试管中固体加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变为蓝色. |
| 序号 | 实验内容 | 实验结论 | 实验反思 |
| 实验1 | 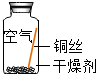 | 在干燥环境中,铜不易生锈. | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
| 实验2 | 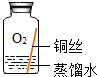 | ||
| 实验3 |  | ||
| 实验4 | 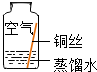 | 铜生锈的条件是 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、0.03%<ω<2% |
| B、0.48%<ω<0.72% |
| C、2.24%<ω<3.36% |
| D、2.48%<ω<3.60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com