
| A. | 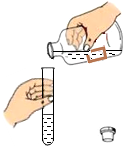 倾倒液体 | B. | 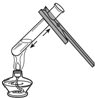 加热液体 | C. | 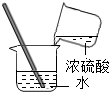 稀释浓硫酸 稀释浓硫酸 | D. | 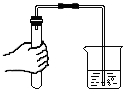 检查气密性 |
分析 A、根据液体药品的取用方法进行分析判断.
B、根据给试管中得液体加热的方法进行分析判断.
C、根据稀释浓硫酸的方法分析.
D、根据检查装置气密性的方法进行分析判断.
解答 解:A、取用液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中所示操作错误.
B、给液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的,图中所示操作正确.
C、稀释浓硫酸时要把浓硫酸缓缓倒入水中,且不断用玻璃棒搅拌,图中所示操作正确.
D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;反之则相反.图中所示操作正确.
故选A.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:解答题
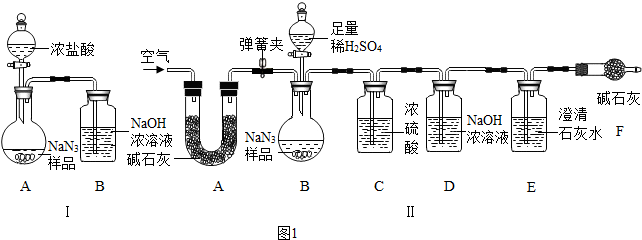
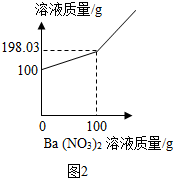
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
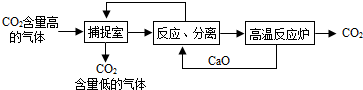
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铜具有良好的导电性 | B. | 铁锅炒菜是利用铁的导热性 | ||
| C. | 焊锡(锡铅合金)的熔点比锡高 | D. | 铁在潮湿的空气中容易生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
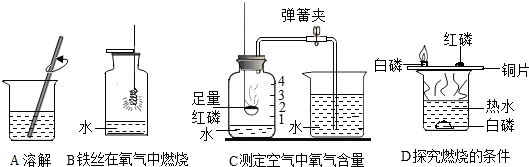
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com