
 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:
 28、小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
28、小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.| 操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中, 加入适量盐酸,塞上带导管的单孔塞 加入适量盐酸,塞上带导管的单孔塞 把导管插入另一试管里的石灰水中 把导管插入另一试管里的石灰水中 . |
有气体产生,气体使石灰水变浑浊. | 猜想2 成立 |
| ②在上述反应后的试管 中加少量品红溶液. | 品红溶液褪色 品红溶液褪色 . |
查看答案和解析>>
科目:初中化学 来源:江苏省太仓市2012届九年级升学模拟考试化学试题 题型:013
某校化学兴趣小组设计用下图所示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.[查阅资料]:
①Fe与浓H2SO4反应,加热,有SO2生成;
②C与浓H2SO4反应,加热,有CO2和SO2生成;
③SO2可使澄清石灰水变浑浊;
④SO2可使品红溶液的红色褪去,而CO2不能;
⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能;⑥碱石灰的主要成分为NaOH和CaO.
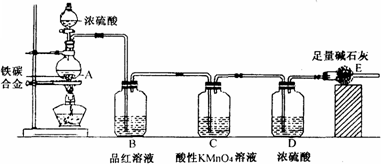
[实验探究]称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg.下列对实验结果分析正确的是
A.B装置作用是为了除去反应中生成的SO2
B.依据实验数据计算得出铁的质量分数为(3b-11m)/11m
C.装置内的CO2难以赶尽,E质量偏小,导致铁的质量分数偏小
D.SO2未被酸性KMnO4除尽也可能会引起铁的质量分数偏小
查看答案和解析>>
科目:初中化学 来源:黑龙江省期末题 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com