
氯化钠和氯化镁是重要的化工原料.某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案:
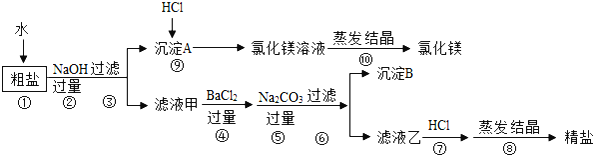
请回答下列问题:
(1)步骤①溶解过程中用玻璃棒搅拌的目的是_____。
(2)步骤④⑤的顺序颠倒会引发的后果是_____。
(3)滤液乙中所含的溶质除氯化钠外还含有_____;沉淀B中除含碳酸钙、碳酸钡外还含有_____;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?_____原因是_____。
(4)写出步骤⑨中反应的化学方程式_____.属于_____反应(填基本反应类型)。
(5)实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有_____个。
科目:初中化学 来源:2020年山东省济宁市中考一模化学试卷 题型:单选题
A、B、C、D 分别是 HCl、BaCl2、AgNO3、Na2CO3 四种物质的无色溶液中的某一种,先将它们两两混合,产生的现象如下表所示:
反应物 | A+B | C+D | A+D | C+A | D+B |
现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
由上表可知:A、B、C、D 依次是:
A.HCl、BaCl2、AgNO3、Na2CO3
B.AgNO3、HCl、Na2CO3、 BaCl2
C.BaCl2、Na2CO3、AgNO3、HCl
D.AgNO3、HCl、BaCl2、Na2CO3
查看答案和解析>>
科目:初中化学 来源:2020年北京市朝阳区九年级下学期延期开学自我练习(零模)化学试卷 题型:简答题
物质的用途与其性质密切相关,用化学方程式回答问题。
(1)氢氧化铝可用于治疗胃酸过多的原因是____________________________。
(2) pH<5.6 的雨水称为酸雨,正常雨水也呈酸性的原因是____________________。
(3)建筑工地的工人下班前,通常在用剩的石灰浆上覆盖一层沙土,以便第二天使用,原因是________。
查看答案和解析>>
科目:初中化学 来源:2020年贵州省黔西南布依族苗族自治州兴义市中考模拟化学试卷 题型:填空题
根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解 | NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
(1)10 ℃时,氯化钠的溶解度是_______g。
(2)与硝酸钾相比较,氯化钠的溶解度受温度变化影响_______(填“较大”或“较小”)。
(3)20 ℃时,在100 g水中加入40 g硝酸钾,充分搅拌后,将溶液温度升高到30 ℃(不考虑水分蒸发),所得溶液是____________(填“饱和溶液”或“不饱和溶液”)。
查看答案和解析>>
科目:初中化学 来源:2020年贵州省黔西南布依族苗族自治州兴义市中考模拟化学试卷 题型:单选题
下列所示的实验方法或操作正确的是( )
A. 二氧化碳验满 B.
二氧化碳验满 B.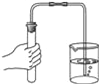 检查装置气密性
检查装置气密性
C.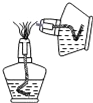 点燃酒精灯 D.
点燃酒精灯 D.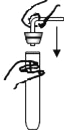 塞紧橡皮塞
塞紧橡皮塞
查看答案和解析>>
科目:初中化学 来源:重庆市万州区2019-2020学年九年级下学期2月月考化学试卷 题型:推断题
某固体可能由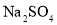 、NaCl,
、NaCl,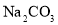 、
、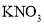 中的一种或几种组成,现实验如下:
中的一种或几种组成,现实验如下:
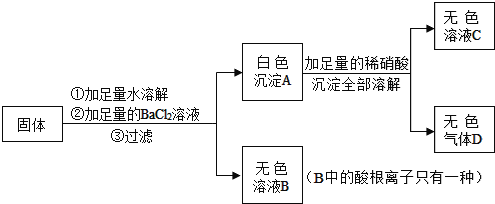
试回答:
(1)白色沉淀A的化学方式为_____。
(2)原固体中一定含有_____,一定不含有_____,可能含有_____。
(3)为检验上述可能含有的物质是否一定存在
甲同学设计了如下实验方案:
①取少量固体溶于水,加入足量的Ba(NO3)2溶液,充分反应后,过滤;
②取滤液加入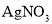 溶液,观察有无白色沉淀生成,由此得出结论。在上述某同学的实验方案①中,加入足量的
溶液,观察有无白色沉淀生成,由此得出结论。在上述某同学的实验方案①中,加入足量的 溶液的目的是_____。
溶液的目的是_____。
乙同学设计了如下实验方案:
取少量固体溶于水,加入_____溶液,充分反应后,再加入_____溶液,观察有白色沉淀生成,由此得出结论是_____。
查看答案和解析>>
科目:初中化学 来源:重庆市万州区2019-2020学年九年级下学期2月月考化学试卷 题型:单选题
向硫酸铜溶液中加入一定量的铝粉,完全反应后过滤,得到滤渣和蓝色滤液,下列说法正确的是( )
A.向滤渣中滴加稀盐酸,无气泡产生
B.滤液中只有硫酸铜
C.滤渣中一定有铜,可能有铝
D.滤液中只有硫酸铝
查看答案和解析>>
科目:初中化学 来源:天津市红桥区2019-2020学年九年级下学期会考化学试卷 题型:实验题
某化学兴趣小组做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液。
实验一:如图是同学做粗盐提纯实验的操作示意图。回答下列问题:
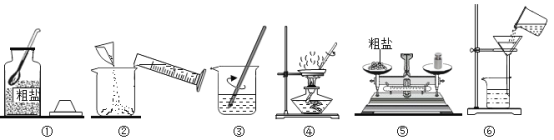
(1)操作③中用玻璃棒搅拌的作用是_____。
(2)操作⑥中的错误是_____。
(3)操作④中,当观察到____时,停止加热。
实验二:用提纯得到的精盐配制50g5%的氯化钠溶液,经检测,所配溶液溶质质量分数偏小,其原因可能有____(填序号)。①氯化钠固体仍然不纯 ②称量时砝码与精盐的位置放反 ③量取水时,俯视读数 ④配好装瓶时,有少量溶液洒出
(拓展延伸)为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液呈碱性]
(1)写出加入BaCl2溶液发生反应的化学方程式____。
(2)写出加入NaOH溶液发生反应的化学方程式:____。
(3)加入过量Na2CO3溶液的目的是____。
查看答案和解析>>
科目:初中化学 来源:广西北海市2019-2020学年九年级下学期线上教学质量检测化学试卷 题型:流程题
矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属离子含量达到排放标准。
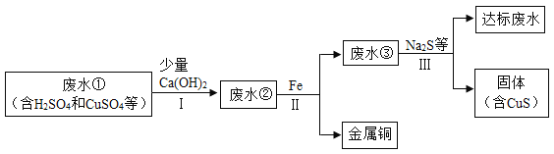
已知:步骤Ⅰ中Ca(OH)2与CuSO4并没有发生反应;CuSO4属于一种常见的重金属盐。
(1)步骤I发生反应的化学反应方程式为______。
(2)废水①中一定含有的阳离子有____。
(3)加入少量Ca(OH)2可以降低步骤Ⅱ中铁的消耗量,原因是____。
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中还含有较多的____(填化学式或离子符号);达标废水pH比废水①pH ____(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com