
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
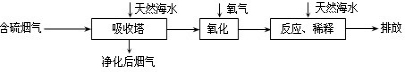
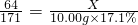


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:阅读理解
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
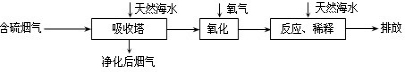
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
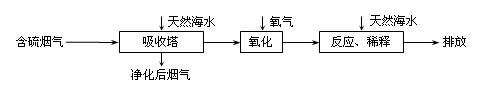
查看答案和解析>>
科目:初中化学 来源:2011届辽宁省锦州市中考化学模拟试卷 题型:推断题
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验。
【相关信息】①每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |

查看答案和解析>>
科目:初中化学 来源:2011年江苏省如皋市中考化学一模试卷(解析版) 题型:解答题
| 测定时间/h | 1 | 2 | 3 | 4 | |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
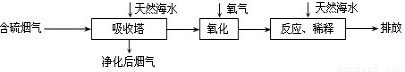
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com