
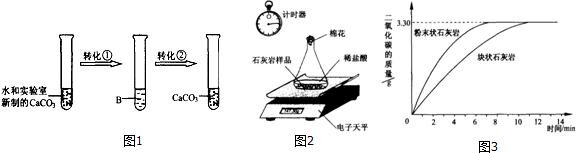
分析 (1)由图示的现象和提供的信息,根据CaCO3+CO2+H2O=Ca(HCO3)2、Ca(HCO3)2=CaCO3+CO2↑+H2O分析;
(2)①结合题干、图1和图2中的量,可以得到本小题的答案;
②由图2中的图象对比可以得出本小题的答案;
③由石灰石的质量和图2中所示的二氧化碳的质量,根据碳酸钙与稀盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数.
解答 解:(1)由图中不溶性的碳酸钙经转化①变成可溶性的,结合题干中的信息“石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2”可知,气体A是二氧化碳,其化学式为:CO2;
B中的溶质是碳酸氢钙,其化学式为:Ca(HCO3)2;
由图中可溶性的碳酸氢钙经转化②变成不溶性的碳酸钙,结合题干中提供的信息“溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2═CaCO3↓+CO2↑+H2O”可知能实现这一转化的方法有加热或减压,两方法中加热是通常采用的基本操作方法,
故答案为:CO2;Ca(HCO3)2;加热;
(2)①结合图2所示的两个量可知图1中实验中数据记录纸上应该连续记录的实验数据是电子天平示数和计时器示数,
故答案为:电子天平示数(或锥形瓶体系质量);计时器示数(或反应时间);
②由图2所示的图象可知:在反应结束前某一温度时,粉末状的石灰岩产生的二氧化碳多,是由于粉末状的石灰岩与稀盐酸的接触面积大,因此反应速率快;块状的石灰岩产生的二氧化碳少,是由于块状的石灰岩与稀盐酸的接触面积小,因此反应速率慢,
故答案为:大;快;
③解:称取20.00g样品平均分成两份,每份的质量为:$\frac{20.00g}{2}$=10.00g,
设每份样品中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.30g
$\frac{100}{x}=\frac{44}{3.30g}$
则:x=$\frac{100×3.30g}{44}$=7.50g,
样品中碳酸钙的质量分数为:$\frac{7.50g}{10.00g}$×100%=75.0%,
答:样品中碳酸钙的质量分数为75.0%.
点评 本题主要考查分析和应用信息解答实际问题的能力、影响反应速率的因素和有关化学方程式的计算,题目难度中等,要结合物质的性质和反应规律进行综合分析,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在水净化的单一操作中,蒸馏的净化程度最高 | |
| B. | 水通过三态变化实现天然循环 | |
| C. | 用密度约为1.04g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平 | |
| D. | 用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
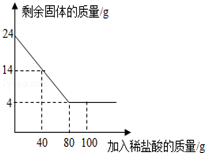 某化学兴趣小组为了测定当地的石灰石(主要成分是CaCO3)的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
某化学兴趣小组为了测定当地的石灰石(主要成分是CaCO3)的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
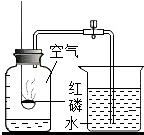 用来测空气成分的方法很多,如图所示的使用红磷在空气中燃烧的测定实验.实验过程是:将集气瓶容积等分五份,点燃燃烧匙里足量的红磷,伸入集气瓶中并把塞子塞紧,待红磷熄灭并冷却后,打开弹簧夹.
用来测空气成分的方法很多,如图所示的使用红磷在空气中燃烧的测定实验.实验过程是:将集气瓶容积等分五份,点燃燃烧匙里足量的红磷,伸入集气瓶中并把塞子塞紧,待红磷熄灭并冷却后,打开弹簧夹.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
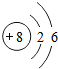 ,
,查看答案和解析>>
科目:初中化学 来源: 题型:解答题
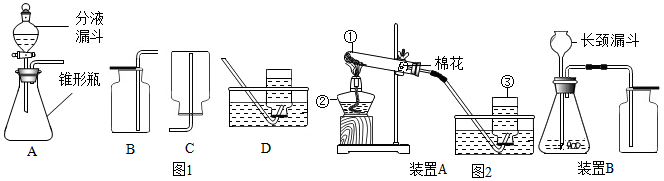
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 构成物质的基本粒子:分子、原子、离子 | |
| B. | 常见的可燃性气体:氢气、一氧化碳、天然气(主要成分甲烷)4 | |
| C. | 常见的合金:硬铝、青铜、氧化铁 | |
| D. | 溶于水放热的物质:氢氧化钠固体、食盐固体、硝酸铵固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com