
分析 碳与氧化铜反应生成铜的二氧化碳,由质量守恒定律,试管中减少的质量即为生成二氧化碳的质量,由反应的化学方程式列式计算出参加反应的碳和氧化铜的质量,进而计算出混合物中氧化铜和炭粉的质量比.
解答 解:由质量守恒定律,生成二氧化碳的质量为100g-78g=22g.
设参加反应的碳和氧化铜的质量分别是x、y
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
12 160 44
x y 22g
$\frac{12}{44}=\frac{x}{22g}$ x=6g
$\frac{160}{44}=\frac{y}{22g}$ y=80g
完全反应后试管中剩余的反应物可能是碳或氧化铜,剩余的质量为100g-6g-80g=14g.
则混合物中氧化铜和炭粉的质量比可能为(14g+6g):80g=1:4,也可能为6g:(80g+14g)=3:47.
故答案为:1:4;3:47.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
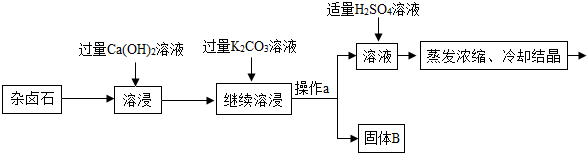
| 实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
| a | 25 | 2.5 | 72.4 |
| b | 40 | 2.5 | 86.55 |
| c | 40 | 3 | 90.02 |
| d | 60 | 3 | 91.98 |
| e | 60 | 4 | 91.45 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验一 | 实验二 | 实验三 | |
| 实验方案 | 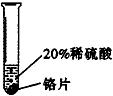 |  | 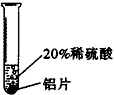 |
| 实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色 | 无现象 | 铝片表面产生气泡较快 |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是Al、Cr、Cu(或“②”). | |||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
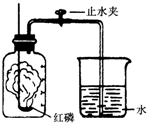 某同学设计了测定空气中氧气含量的实验,实验装置如图,实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图,实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com