
【题目】CuCl2是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上以辉铜矿(主要含有Cu2S、Fe2O3及一些不溶性杂质)为原料制备CuCl22H2O晶体的工艺流程如下:

请回答下列问题:
(1)焙烧中生成黑色固体,反应的化学方程式为_______________________。
(2)酸浸时发生的化学方程式为___________________(写出一种),为加快反应速率,以下措施无法达到目的是_________________。
A.延长酸浸时间 B.将辉铜矿粉碎 C.适当增加盐酸浓度
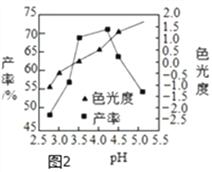
(3)色光度是产品质量指标之一,合格CuCl22H2O晶体的色光度范围为-0.5~0.5,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是____________。
(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是_________。
【答案】 Cu2S+O2![]() 2CuO+SO2 CuO + 2HCl ==CuCl2 + H2O(或Fe2O3 + 6HCl==2FeCl3 + 3H2O) A 3.5-4.0 防止氯化铜溶解,提高产率
2CuO+SO2 CuO + 2HCl ==CuCl2 + H2O(或Fe2O3 + 6HCl==2FeCl3 + 3H2O) A 3.5-4.0 防止氯化铜溶解,提高产率
【解析】(1)高温条件下,硫化亚铜和氧气反应生成氧化铜和二氧化硫,反应的化学方程式为:Cu2S+O2![]() 2CuO+SO2 (2)酸浸时,氧化铜和稀盐酸反应生成氯化铜和水,氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:CuO + 2HCl ==CuCl2 + H2O,Fe2O3 + 6HCl==2FeCl3 + 3H2O。A.延长酸浸时间不能加快反应速率;B.将辉铜矿粉碎,增大了反应物接触面积,能够加快反应速率;C.适当增加盐酸浓度,可用加快反应速率。故填A。(3)由图可知,pH为3.5---4.0时,产率较高,并且CuCl22H2O晶体的色光度范围在-0.5---0.5之间,属于合格产品,因此综合考虑,制备时应控制pH的较合理范围是3.5---4.0;(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是防止氯化铜溶解,提高产率。
2CuO+SO2 (2)酸浸时,氧化铜和稀盐酸反应生成氯化铜和水,氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:CuO + 2HCl ==CuCl2 + H2O,Fe2O3 + 6HCl==2FeCl3 + 3H2O。A.延长酸浸时间不能加快反应速率;B.将辉铜矿粉碎,增大了反应物接触面积,能够加快反应速率;C.适当增加盐酸浓度,可用加快反应速率。故填A。(3)由图可知,pH为3.5---4.0时,产率较高,并且CuCl22H2O晶体的色光度范围在-0.5---0.5之间,属于合格产品,因此综合考虑,制备时应控制pH的较合理范围是3.5---4.0;(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是防止氯化铜溶解,提高产率。


 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:
【题目】目前,化石燃料是人类生产、生活的主要能源。随着全球能量使用的增长,化石燃料等不可再生能源将日趋枯竭。世界各国人民的节能意识也日趋增长(如图是我国的节能标志),科学家也在开发新能源、研制节能产品、提高化学能的转化效率等方面做着积极的努力。请你回答:

(1)有待继续开发、利用的能源________________________________(请回答三种)。
(2)用化学反应方程式表示出两个由化学能转化为内能的例子:
①________________________;
②________________________。
(3)生产、生活中存在着化学能和电能的相互转化,请你分别举例:
①由化学能转化为电能__________________________________________;
②由电能转化为化学能__________________________________________。
(4)氢气具有热值高且____________________________的特点,因此被认为是最清洁的燃料。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
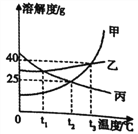
A. 若乙中含有少量甲,可采用冷却热饱和溶液的方法提纯乙
B. 当t1℃< t<t2℃时,丙溶液的质量分数大于甲溶液
C. 甲、乙、丙三种物质的饱和溶液从t1℃升温至t3℃,所得溶液的质量分数关系是甲=乙>丙
D. 将t3℃时甲、乙、丙三种物质的饱和溶液各恒温蒸发10g水,析出固体质量的关系是甲=乙>丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量。记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。下列判断正确的是
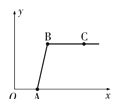
A.图中纵坐标(y)表示生成CO2的质量
B.反应进行到C点时,溶液中的溶质只有NaCl
C.C点溶液的pH>7
D.AB段发生反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知铝在空气中会生成一层致密的氧化膜(Al2O3 ),该氧化膜可与稀盐酸发生反应:Al2O3+6HCl===2AlCl3+3H2O。实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如右图。下列说法不正确的是 ( )
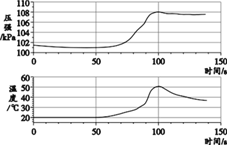
A. 反应过程中有热量放出
B. 0~50 s,发生稀盐酸与 Al2O3 的反应
C. 50 s 时,溶液中溶质为 AlCl3
D. 100 s~140 s,压强减小是因为温度降低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合图示回答下列问题:
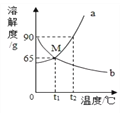
⑴t2℃ a物质的溶解度是90g,表示t2℃时,在_______g水中溶解90g a物质达到饱和。t2℃时向50g水中加入60g的a 物质,形成________(填“饱和”或“不饱和”)溶液。
⑵使接近饱和的溶液变成饱和溶液,可采用加溶质、降温方法的物质是______(填“a”或“b”)。
⑶t1℃时100g a的饱和溶液溶质质量分数________填“=”或“>” 或“<”)200g b的饱和溶液的溶质质量分数。
⑷将t2℃等质量的a、b饱和溶液分别降温到t1℃时,下列有关说法正确的是_______填字母)。
A.a溶液析出晶体 B.b溶液析出晶体 C.b溶液的溶质质量分数不变,但变成不饱和溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如下图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑
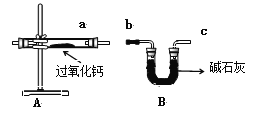
(实验探究)
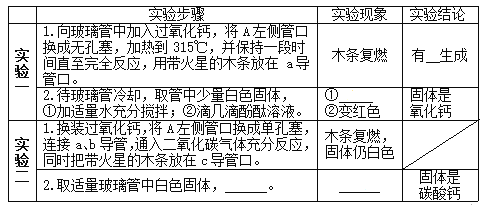
________________ ___________________ ________________ ____________
(解释与结论)
⑴由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
⑵由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:________。
⑶B装置中碱石灰的作用是:_________
(分析与计算)
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为 _______。
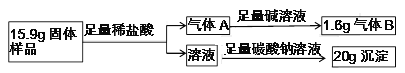
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们发现新鲜的苹果汁在空气中放置一段时间后会变色,仿佛铁生锈一样。于是,研究性小组同学设计并进行实验,探究苹果汁变色的原因。
(查阅资料)a.苹果汁中含有0.001%的二价铁物质,同时也含有多酚类物质,多酚可与空气中的氧气反应变为褐色。
b.二价铁在空气中或与浓硝酸反应都能变为三价铁,且三价铁的溶液为黄色。
c.硫氰化钾(KSCN)溶液遇二价铁溶液不变色,遇三价铁溶液变红色。
(猜想与假设)猜想Ⅰ.苹果汁变色与苹果中的铁元素有关;
猜想Ⅱ.苹果汁变色是苹果汁中的多酚物质与空气中的氧气反应的结果。
(进行实验)
编号 | 实验操作 | 实验现象 | |||
实验1 |
| ②中未出现明显变化 ③_________ | |||
实验2 | 分别放置于空气中一段时间 (如下图所示)
| 试管编号 | 1min | 10min | 24小时 |
① | 黄褐色 | 褐色 | 深褐色 | ||
② | 无明显变化 | 无明显变化 | 无明显 变化 | ||
③ | 略有些黄色 | 浅黄 | 黄色 | ||
(解释与结论)(1)实验1验证了苹果汁中含有二价铁物质。在该实验试管③中的现象是______________;
(2)实验2的试管②中,FeSO4溶液中溶质的质量分数x的数值为__________,该实验得出的结论是猜想Ⅰ不成立;
(进一步探究)验证猜想Ⅱ成立的操作:将除去________的空气通入鲜苹果汁中;观察到实验现象是__________________________;
(反思与应用)生活中为了防止苹果汁变色,可以采用的一种方法是:________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是初中化学的一些基本实验,请根据实验内容回答下列问题。
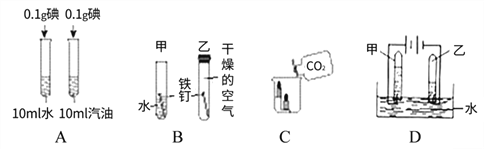
(1)A实验欲探究影响物质溶解性的因素是_______。
(2)B实验说明铁钉生锈与________有关。
(3)C实验得出CO2的性质有_______。
(4)D实验中,甲试管内的气体是_______,该实验得出关于水的组成的结论是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com