
分析 根据氯化钡能与碳酸钠反应生成碳酸钡沉淀分析解答;酚酞试液在碱性溶液中变红;玻璃棒搅拌能促进物质间的接触,加快反应的进行;碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳;根据盐酸的质量求碳酸钠的质量,进而求算碳酸钠的质量分数;硝酸银能与氯化钠反应生成氯化银沉淀和硝酸钠,据此解答.
解答 解:(1)②氯化钡能与碳酸钠反应生成碳酸钡沉淀,故可以加入碳酸钠溶液观察是否产生白色沉淀的方法证明氯化钡的剩余,故填:静置,取少量上层清液,加入少量碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余;
(2)③a、根据酚酞试液颜色的变化判断反应是否恰好完全进行,故填:判断是否恰好完全反应;
b、玻璃棒搅拌能促进物质间的接触,加快反应的进行,故填:使反应物充分接触,完全反应;
c、碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,设碳酸钠的质量为x,则有
Na2CO3+2HCl═2NaCl+H2O+CO2↑;
106 73
x 7.3g×10%
$\frac{106}{73}=\frac{x}{7.3g×10%}$
x=1.06g
故碳酸钠的质量分数为:$\frac{1.06g}{10.6g}×100%$=10%;
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑,1.06g,10%;
(3)②硝酸银能与氯化钠反应生成氯化银沉淀和硝酸钠,故填:AgNO3+NaCl═AgCl↓+NaNO3;
④取一些样品并没有称量,故无法进行计算,故填:开始没有称量样品的质量.
点评 本题考查的是混合物成分及其含量的实验探究,完成此题,可以依据已有的物质的性质结合题干提供的信息进行.


 寒假学与练系列答案
寒假学与练系列答案科目:初中化学 来源: 题型:选择题
| A. | 霉变的大米蒸熟后食用无害 | B. | 用灼烧的方法能鉴别绦纶和羊毛 | ||
| C. | 用食醋除去水壶中的水垢 | D. | 用加热煮沸的方法降低水的硬度 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
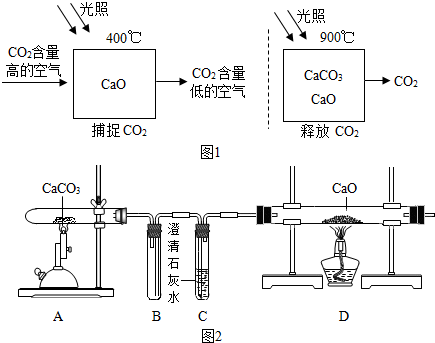
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃,实验时打开导管中的开关.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃,实验时打开导管中的开关.| 内容 步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
| Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和 烧杯中导管口放置一 小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭,点燃木炭后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
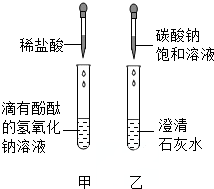 同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管 中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小林的猜想正确. |
| ②产生白色沉淀、溶液为无色. | 小刚的猜想正确. | |
| ③无白色沉淀,溶液呈红色. | 小红的猜想正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可作钾肥 | B. | 由三种元素组成 | ||
| C. | K2CO3属于盐类 | D. | 碳元素的化合价是+2价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 金属材料与人类的生产和生活密切相关.
金属材料与人类的生产和生活密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
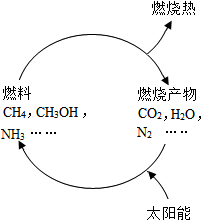 (1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.
(1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com