
工业上可用电解氯化钠溶液的方法制氢氧化钠,反应的化学方程式为
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
如果有58.5g的氯化钠反应,生成氢气多少克?
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
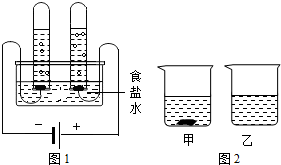 (2011?顺义区一模)水是生命之源,通过化学学习,我们进一步认识了水的作用.
(2011?顺义区一模)水是生命之源,通过化学学习,我们进一步认识了水的作用.
| ||
| ||
| ||
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com