
【题目】水和溶液在生命活动和生活中起着十分重要的作用。
(1)生活中可以用_________区分硬水和软水,可以通过________的方法降低水的硬度。
(2)海水中含有大量的氯化钠,可以通过_________方法获得粗盐,可用此方法提纯氯化钠的原因是____________ 。
(3)已知20℃时,氯化钠的溶解度为36g,则用18g氯化钠配制100g氯化钠溶液,所得溶液的浓度为____________。
科目:初中化学 来源: 题型:
【题目】用化学用语填空:
①2个氢原子__________;
②氖气___________;
③水中氧元素为﹣2价____________;
④4个氢氧根离子______________;
⑤地壳中含量最多的金属元素:____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在工业上,精炼铜、镀铜以及制造各种铜的化合物时,都要应用硫酸铜.某工广用硫化铜![]() 为原料制备硫酸铜,拟选择以下两个方案:
为原料制备硫酸铜,拟选择以下两个方案:
[方案一]硫化铜在催化剂的作用下跟空气中的氧气发生化合反应,生成硫酸铜.
[方案二]![]() ,
,![]() .
.
(1)请写出方案一反应的化学方程式:______.
(2)从环境保护的角度考虑,两个方案中______(填“方案一”或“方案二”)更合适,理由是______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3 、MgO、CaO等,生产工艺流程示意如下:

[相关资料]不溶性碱受热分解后生成对应的氧化物。
(1)将菱锌矿研磨成粉的目的是 _______
(2)完成“氧化除铁”步骤中反应的化学方程式:2Fe(OH)2+Ca(ClO)2+2H2O=2____+CaCl2,这个反应中有______种元素的化合价发生了变化。
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,化学式是FeO(OH),组成元素Fe、O、H的质量比是________;
(4)根据下表数据,调节“滤液2”的pH范围为 _________;
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | - | - |
沉淀完全的pH | 12.4 | 8.0 | - | - |
开始溶解的pH | - | 10.5 | - | - |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是 _______(选填序号).
a大理石粉 b石灰乳 c纯碱溶液 d烧碱溶液
(6)“滤液4”之后的操作依次为 :蒸发浓缩、________、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 _______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是根据工业炼铁的原理设计装置进行的实验,同时检验生成物,并收集尾气中含有的未反应的CO,然后进行重复利用。
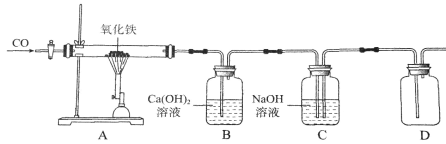
(1)B装置中发生反应的化学方程式__________________。
(2)未反应的CO收集在_______________装置中。
(3)反应一段时间后,C装置溶液中一定含有碳酸钠,可能含有氢氧化钠。请设计实验证明溶液中溶质成分__________________(简要写出实验步骤、现象和结论)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】不少同学都被蚊虫叮咬过,感觉又痛又痒。同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内释放出蚁酸刺激皮肤,课外兴趣小组同学决定对蚁酸进行探究。
(提出问题)蚁酸的成分是什么?它有什么性质?
(查阅资料)蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;蚁酸在一定条件下会分解生成两种氧化物。
(实验探究一)探究蚁酸的酸性。
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成______色,说明蚁酸溶液显酸性;
(2)将锌粒放入盛有蚁酸溶液的试管中,有气泡产生,该气体是__________(填名称)。
(实验探究二)探究蚁酸分解的两种产物。
(3)小芳同学根据蚁酸中含有_________元素,推测出生成物中含有水;
(4)另一种生成物是气体,小敏提出两种猜想:猜想①:该气体是CO2;猜想②:该气体是_________。他们将蚁酸分解产生的气体通过如下装置(铁架台已略去),观察现象。
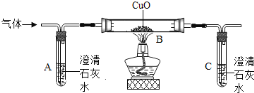
(5)实验时装置A中无明显变化,则猜想①_________(填“成立”或“不成立”);
(6)装置B中的现象是________,装置C中发生反应的化学方程式为________________。
(讨论交流)从环保角度看,该装置的缺陷是_________________。
(拓展延伸)
(7)当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是______。
A 牙膏 B 食醋 C 肥皂水 D 烧碱
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
(方案一)样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
实验操作 | 实验现象 | 实验结论 |
取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式: ______________________ |
(2)分析滴加的CaCl2溶液要过量的原因:________________________。
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算出Na2CO3的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为_________。
(方案二)样品与稀硫酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀硫酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好且每步反应或作用都是完全的)。
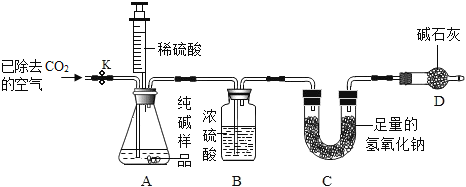
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,再接上装置C和D。其目的是__________________________________________________。
(5)关闭止水夹K,加入足量的稀硫酸(杂质不与稀硫酸反应),装置A中样品产生气体的化学方程式为__________________________________________。该方案中不能用稀盐酸代替稀硫酸的原因是_______________________________________。
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是____________________________________________。根据质量守恒定律,装置_____(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果______(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常见物质的性质和实验是化学研究的重要内容.

(1)配制一瓶符合如图所示的氯化钠溶液,小明同学配制的氯化钠溶液质量分数偏小了, 请写出他操作中可能出现的错误_____,______________________(提示:1g 以下用游码,请答出两 点);若用 15%的氯化钠溶液来配制 500g 溶质质量分数为 0.9%的氯化钠溶液,需要加水 的质量为___________________.
(2)同学们把如图所示的实验完成后,依次将废液缓慢倒入同一洁净的烧杯中.当倾倒液 体时,观察到废液中有气泡产生.
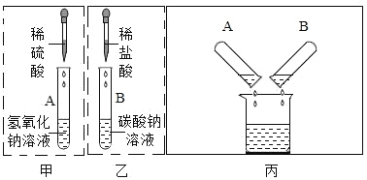
经讨论确定,A 试管中废液里的溶质是_____________________________ (写化学式,下同),B试管中废液里的溶质是___________________________________.
(3)用“侯式联合制碱法”制得的纯碱含有少量的氯化钠,为测定某纯碱样品中碳酸钠的 含量,取 23g 样品置于烧杯中,加水将其溶解,再滴加氯化钙溶液,产生沉淀的质量与加 入氯化钙溶液的质量关系如图所示.求该纯碱样品中碳酸钠的质量分数_______________________.(结果保留一位小 数点)
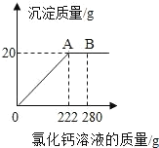
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关化学用语中数字“2”的意义的说法,错误的是( )
①3SO2 ②Mg2+ ③CO2 ④![]() SO4 ⑤O2﹣ ⑥H2O2.
SO4 ⑤O2﹣ ⑥H2O2.
A.表示分子个数的是①
B.表示离子所带电荷数的是②⑤
C.表示化合价数值的是④
D.表示一个分子中含有某种原子个数的是①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com