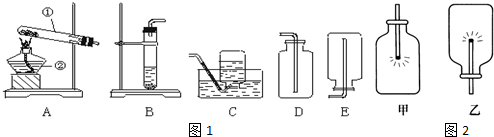
解答:解:(1)①为试管,②为酒精灯;
(2)锰酸钾加热生成锰酸钾、二氧化锰和氧气,文字表达式为:高锰酸钾
锰酸钾+二氧化锰+氧气,一变多,为分解反应;反应属于固体加热制气,可选用发生装置A.氧气是不溶于水的,所以可以选用排水收集,装置为C;氧气密度大于空气,所以可以选择向上排空气法收集,装置为D;
(3)解:第一步:要检查装置的气密性,如果装置漏气,就收集不到氧气,浪费药品;
第二步:检查完装置的气密性,如果装置的气密性好,就把药品装入试管,用带导管的塞子塞紧试管,准备加热制取;
第三步:由于加热过程试管的温度较高所以要把它固定在铁架台上;
第四步:点燃酒精灯,加热试管里面的药品;
第五步:由于氧气不易溶于水故可用排水法收集氧气;
第六步:将导管从水槽中取出;
第七步:熄灭酒精灯.
(4)实验室用装置B制取氧气时,是固液常温型,该反应的文字表达式为:过氧化氢
水+氧气;
(5)操作①不能实现对药品用量及加入速度的控制,而操作②通过缓缓加入溶液的方法控制药品的加入速度及用品,从而达到了控制反应速度的目的,所以①②两种方法的实验现象不相同;因此,要得到平稳的氧气流应采取操作②的方法进行制取;
(6)①做“铁丝在氧气中燃烧”的实验.没有观察到“火星四射”的现象,实验失败的可能原因是:铁丝已经生锈;收集的氧气不纯;温度没有达到铁的着火点等.防止溅落的熔化物炸裂瓶底;集气瓶的底部要放水或铺沙子.
铁在氧气中燃烧生成了四氧化三铁,反应的文字表达式是:铁+氧气
四氧化三铁.该反应由两种物质生成了一种物质,属于化合反应.
②氧气的密度比空气的密度大,收集后要用瓶口向上.如果瓶口向下的话,则收集的氧气可能会逸出.甲图中瓶口向上,而乙图瓶口向下,故乙图中的氧气含量少.氧气又能使带火星的木条复燃.因而在甲中燃烧比在乙更旺.故答案为:氧气的密度比空气的密度大;氧气能助燃(能支持燃烧).
③因该瓶中还有体积为64%的空气,空气中也有氧气,所以这位同学的观点不正确.观察实验记录,收集的氧气占容积的体积分数最低为36%,带火星的木条复燃,此时空气还占64%,所以空气中有氧气的量为:64%×21%≈13%,所以此时瓶内共有氧气的分数为:13%+36%=49%.
故答案为:该瓶中还有体积为64%的空气,空气中也有氧气;49%;
(7)方法①:高锰酸钾需要在加热的条件下才能放出氧气,而加热时也会消耗氧气,不适宜在潜水器里供给氧气.
方法②:水通电分解需要通电,消耗电能,不适宜在潜水器里供给氧气.
方法③:氧化汞需要在加热的条件下才能放出氧气,且生成的汞有毒,不适宜在潜水器里供给氧气.
方法④:过氧化钠固体与二氧化碳反应,常温下即可发生反应,且可把空气中的二氧化碳转化为氧气,供给氧气的同时吸收了人呼出的二氧化碳,适宜在潜水器里供给氧气.
与其它三种方法相比,④这种方法不用加热、不用通电,操作简单,还能将人呼吸产生的二氧化碳转变为呼吸所需的氧气
故答案为:
(1)①试管、②酒精灯;
(2)A、C或D;
高锰酸钾
锰酸钾+二氧化锰+氧气、分解反应;
(3)bcadfe;
(4)过氧化氢
水+氧气;
(5)②;
(6)①氧气不纯、事先未在集气瓶内放少量的水或沙子、铁+氧气
四氧化三铁、化合反应;
②助燃性、密度比空气大;
③瓶内空气中也有氧气、49%;
(7)④、操作方便.



 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案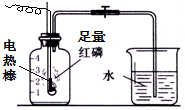 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: