
 某天然矿泉水中元素及物质含量如表所示,请用相关化学用语回答下列问题.
某天然矿泉水中元素及物质含量如表所示,请用相关化学用语回答下列问题.| 矿泉水中主要成分(mg/L) | |
| 偏硅酸(H2SiO3)30-50 硫酸根3-8 氯离子1-5 | 钙7-20 钠3-16 钾2-8 镁6-20 |
分析 (1)硫酸根离子和氯离子都属于阴离子,每个硫酸根离子带2个单位负电荷,每个氯离子带1个单位负电荷;
(2)元素的化合价应该标在元素符号正上方;
(3)二氧化碳分子能够保持二氧化碳的化学性质;
(4)过滤可以把不溶于水的物质除去;
(5)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(6)氧气能够供给呼吸.
解答 解:(1)表中的阴离子是硫酸根离子和氯离子,分别可以表示为SO42-、Cl-.
故填:SO42-,或Cl-.
(2)偏硅酸中,氢元素的化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,硅元素的化合价是+4,可以表示为H2$\stackrel{+4}{Si}$O3.
故填:H2$\stackrel{+4}{Si}$O3.
(3)产自溶洞中的水中含有微量的二氧化碳,保持二氧化碳化学性质的最小粒子是二氧化碳分子,可以表示为CO2.
故填:CO2.
(4)①通过沉淀、过滤、吸附除去水中难溶性杂质,得到的仍然不是纯净水,该选项说法不正确;
②常用的方法有:沉淀、吸附、过滤,通常不用蒸馏,该选项说法不正确;
③通过过滤的方法将不溶于水的固体杂质与水分离开,该选项说法正确;
④用氯气给水杀菌是化学变化,用活性炭净化水是物理变化,该选项说法正确.
故选:③④.
(5)Ca(HCO3)2受热分解的化学方程式为:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑.
故填:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑.
(6)已知过氧化氢的化学式可表示为H2O2,过氧化钾为K2O2,氢元素和钾元素的化合价都是+1,而钙元素的化合价是+2,因此过氧化钙的化学式为CaO2;
若过氧化钾与水反应的方程式表示为2K2O2+2H2O=4KOH+O2↑,则过氧化钙与水的反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑;
使用过氧化钙时,与水反应生成氧气,能够供给呼吸.
故填:CaO2;2CaO2+2H2O═2Ca(OH)2+O2↑;与水反应生成氧气.
点评 本题主要考查学生对化学用语的书写和理解能力,题目重点考查了学生对化学符号的书写,考查全面,注重基础,题目难度较小.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “普通水”是混合物 | B. | 除去氧气后的水不再含有氧元素 | ||
| C. | “普通水”含有氮分子 | D. | “普通水”含有氧分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
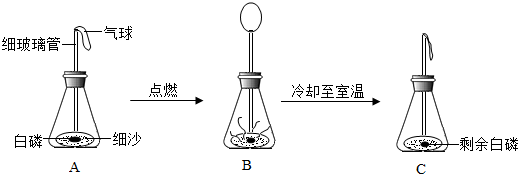
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com