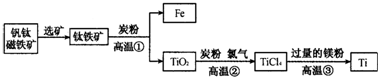
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时,却可与许多常见非金属单质反应,钛是航空、军工、电力等方面的必需原料,地壳中含钛矿石之一种称为金红石(TiO2)矿石.目前大规模生产钛的方法是:
第一步:金红石、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体,该步反应发生的化学方程式是______.
第二步:在氩气的保护下,用过量的镁在加热条件下与TiCl4反应制得金属钛.
(1)此反应的化学方程式______.
(2)如何由上述所得产物中获得纯净金属钛?简述主要步骤并写出有关化学方程式.
解:[第一步]根据“金红石、炭粉混合在高温条件下通入氯气”的叙述,得知反应是三种物质金红石、炭粉和氯气在高温下反应发生的;又“制得TiCl
4和一种可燃性气体”可知生成两种物质,其中可燃性气体的确定为本问题的难点.根据反应前后元素种类不变,反应前含C、O、Ti、Cl四种元素,反应后只能明确在TiCl
4中含有Ti、Cl两种元素,所以判断可燃性气体应含有C、O两种元素.由C、O元素组成的可燃性气体为CO气体.
故答:TiO
2+2Cl
2+2C

TiCl
4+2CO;
[第二步](1)题中明确“在氩气的保护下”说明此反应中稀有气体氩气只作为保护气并不参加反应,所以氩气不是该反应的反应物,反应的反应物为TiCl
4和镁.对于生成物,题中信息只告知“制得金属钛”,其他生成物需要自己分析解决.而题中对此反应没有更多介绍信息,因此在分析反应时可借助“金属(Mg)和盐(TiCl
4)发生置换反应”的规律解答.
故答:TiCl
4+2Mg

Ti+2MgCl
2;
(2)“产物”是由制得的金属钛、生成的氯化镁和因加过量而剩余的镁三种物质所组成.要分离出金属钛,可先使用水溶解氯化镁除去产物中的氯化镁杂质,然后利用钛常温下不与酸反应的性质,把混合物放入足量稀盐酸,除去产物中过量的镁,最后洗涤干燥即得较为纯净的金属钛.
故答:①将混合物溶于水,过滤②在滤渣中加入过量稀盐酸,过滤③洗涤、烘干.Mg+2HCl=MgCl
2+H
2↑
分析:根据题意,题目旨在分析所给信息找出反应发生的过程,用化学方程式表示反应.解答此类问题时,主要抓住反应物、生成物和反应条件的辨别和分析,正确书写有关物质的化学式,一般配平过程不会太复杂.
本题还涉及混合物的分离的实验设计,使用化学方法分离混合时选用的化学试剂应只与混合物中杂质反应,并且反应后不带来新的杂质.
点评:初中化学中“可燃性气体”主要有一氧化碳、氢气、甲烷三种气体.

 TiCl4+2CO;
TiCl4+2CO; Ti+2MgCl2;
Ti+2MgCl2;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案