
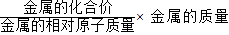 ,可由反应消耗金属锌的质量计算产生氢气的质量;
,可由反应消耗金属锌的质量计算产生氢气的质量; ×100%,可通过计算稀硫酸中硫酸的质量求出稀硫酸的质量分数.
×100%,可通过计算稀硫酸中硫酸的质量求出稀硫酸的质量分数. ×6.5g=0.2g<0.4g;
×6.5g=0.2g<0.4g;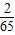 ×13g=0.4g;而小勇反应结束后所加入的13g有剩余而未完全反应,因此所得到氢气的质量小于0.4g;故B正确;
×13g=0.4g;而小勇反应结束后所加入的13g有剩余而未完全反应,因此所得到氢气的质量小于0.4g;故B正确;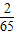 ×6.5g=0.2g,而不是大于0.2g;若13g锌完全反应,产生氢气的质量=
×6.5g=0.2g,而不是大于0.2g;若13g锌完全反应,产生氢气的质量= ×13g=0.4g;而小勇反应结束后所加入的13g有剩余而未完全反应,因此所得到氢气的质量大于或等于0.2g而小于0.4g.故C不正确;
×13g=0.4g;而小勇反应结束后所加入的13g有剩余而未完全反应,因此所得到氢气的质量大于或等于0.2g而小于0.4g.故C不正确; ×100%,而小明同学的实验无法确定稀硫酸中的硫酸是否完全反应,不能确定稀硫酸中硫酸的质量;小勇实验可以判断硫酸完全反应,但却无法计算硫酸的质量;因此,两个实验的数据都不能确定稀硫酸的溶质的质量分数;故D不正确;
×100%,而小明同学的实验无法确定稀硫酸中的硫酸是否完全反应,不能确定稀硫酸中硫酸的质量;小勇实验可以判断硫酸完全反应,但却无法计算硫酸的质量;因此,两个实验的数据都不能确定稀硫酸的溶质的质量分数;故D不正确;

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| A、反应后小明所得溶液中的溶质只有硫酸锌 | B、反应后小勇所得溶液中可能含硫酸 | C、两位同学实验中生成氢气的质量均少于0.4g | D、原稀硫酸中溶质的质量分数一定大于9.8%小于19.6% |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、反应后小明所得溶液中的溶质只有硫酸锌 | B、两位同学实验中生成氢气的质量均小于0.4g | C、两位同学实验中生成氢气的质量均大于0.2g | D、原稀硫酸中溶质的质量分数一定大于9.8%小于19.6% |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com