
甲、乙两同学用如下图的实验装置测定铜和氧化铜混合物中铜元素的含量.
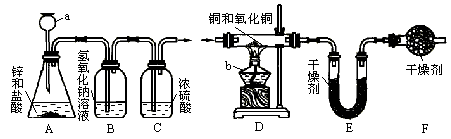
试回答下列有关问题:
(1)仪器a、b的名称为a________,b________.
(2)A中可观察到的现象为________,反应的化学方程式为________.
(3)C装置的作用是________.
(4)测定方法:同学甲称量反应前后D装置中玻璃管及其固体物质的质量,同学乙称量反应前后E装置的质量并验证同学甲的测定结果.已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,则同学乙测定的原混合物中铜元素的质量分数为________(假设各装置中的反应或吸收都是完全的).
(5)F装置的作用是吸收空气中的水蒸气,按同学乙的方法,如不加F装置,会使实验结果________(填“偏低”或“偏高”).
科目:初中化学 来源: 题型:阅读理解
| 5n |
| 2 |
| ||
| ||
| ||
查看答案和解析>>
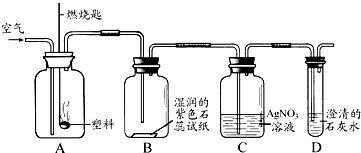
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源:绵阳 题型:填空题
| 5n |
| 2 |
| ||
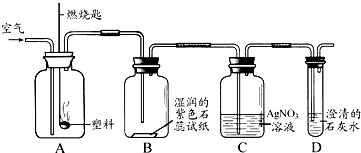
查看答案和解析>>
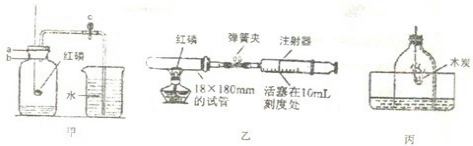
科目:初中化学 来源:江苏省模拟题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com