
【题目】粗盐中含有Mg![]() 、Ca
、Ca![]() 等杂质,工业提纯粗盐的工艺流程如图所示
等杂质,工业提纯粗盐的工艺流程如图所示

(1)Ca(OH)2溶液的pH____________(填“>”、“=”或“<”)
(2)步骤①反应的化学方程式为____________________________;
(3)步骤④加入适量盐酸的目的是除去滤液中的_____________;
(4)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有___________.
【答案】> Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓ Na2CO3和NaOH; CaCl2
【解析】
(1)Ca(OH)2溶液呈碱性,pH>7;
(2)Ca(OH)2溶液只能与粗盐水中的MgCl2反应生成氢氧化镁和氯化钙,化学反应方程式是:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓;
(3)步骤①中过量的氢氧化钙和生成的氯化钙与步骤②中过量的碳酸钠反应碳酸钙沉淀、氯化钠、氢氧化钠,所以步骤④加入适量的盐酸可以除去滤液中步骤②加入的多余的Na2CO3和生成的NaOH;
(3)碳酸钠能与氯化镁反应生成碳酸镁和氯化钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙。若步骤①和步骤②的顺序颠倒,加入过量的碳酸钠溶液能除去氯化镁和氯化钙,再加入过量的氢氧化钙能除去过量的碳酸钠,过滤后的滤液中存在氯化钠、氢氧化钠(生成的)和氢氧化钙(过量的),再加入适量稀盐酸,氢氧化钠与盐酸反应生成氯化钠,氢氧化钙与盐酸反应生成氯化钙,最后形成的溶液中含有氯化钠、氯化钙,氯化钙的化学式是CaCl2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的是( )
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 |
| B | 探究氧气对铁钉锈蚀的影响 |
|
C | 探究空气是燃烧的必要条件 |
| D | 探究空气与呼出的二氧化碳含量不同 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g。请计算:
(1)生成氧气的质量为 g;
(2)原混合物中氯酸钾的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水晒盐可得到大量粗盐(NaCl中含有MgCl2、Na2SO4、CaCl2和泥沙等杂质),某氯碱厂用电解精制饱和食盐水法制取NaOH、H2和Cl2,工艺流程如图所示。
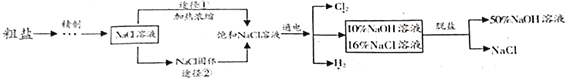
下列说法不正确的是
A. 精制时既发生了物理变化也发生了化学变化
B. 工业生产中应选择途径①制备NaCl饱和溶液
C. 电解时的反应为2NaCl+2H2O=2NaOH+H2↑+Cl2↑,该过程电能转化为化学能
D. 脱盐工序是利用NaCl和NaOH在溶解度上的差异,通过蒸发结晶趁热过滤分离得到NaCl晶体和NaOH溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案中,设计合理的是( )
A. 实验室制备Cu![]() ,将CuO中加入足量的水
,将CuO中加入足量的水
B. 鉴别NaOH溶液和Ca![]() 溶液,取样分别通入适量的C
溶液,取样分别通入适量的C![]()
C. 除去生石灰中的少量CaC![]() :将混合物中加入过量的稀盐酸
:将混合物中加入过量的稀盐酸
D. 分离Ba![]() 固体和NaCl固体,加入适量的NaC
固体和NaCl固体,加入适量的NaC![]() 溶液过滤
溶液过滤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。下列说法不正确的是
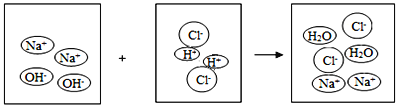
A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】五氧化二磷固体被冷水吸收会生成剧毒的偏磷酸,有关偏磷酸的叙述正确的是( )

A. 偏磷酸由氢、氧、磷三种原子构成
B. 偏磷酸分子中氧元素的质量分数最大
C. 偏磷酸分子中质子总数一定等于电子总数
D. 偏磷酸中氢、磷、氧三种原子的质量比为3:1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某活动小组的同学利用氯酸钾和二氧化锰共热制取一定量的氧气。混合27.6g氯酸钾和2.0g二氧化锰,加热制取一定量的氧气后,停止反应,测得剩余固体中二氧化锰的质量分数为10%。请计算:
(1)剩余固体的质量_____________________________________。
(2)制得氧气的质量______________________________________。
(3)未分解的氯酸钾的质量______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在水的处理过程中,高铁酸钾(K2FeO4)投入水中发生氧化反应,可直接氧化氨态氮、硫化氢,既能除臭又可解毒、增氧,其强烈氧化作用可使微生物体内的酶失活,抑制其蛋白质及核酸合成,投放于池塘,可高效抑制病原菌滋生和藻类过度繁殖,是当前水产养殖上的一种新型底改。198℃以下时能稳定存在,但受热易分解(4K2FeO4![]() 2Fe2O3+4K2O+3O2↑),遇水将变质(4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑)。根据要求回答下列问题:
2Fe2O3+4K2O+3O2↑),遇水将变质(4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑)。根据要求回答下列问题:
(1)取等质量的两份高铁酸钾固体分别加热、与水反应,请观察上述化学方程式,判断充分反应后产生氧气的质量______(填“相等”、“不相等”或“无法确定”)。
(2)为检测实验室新买的高铁酸钾固体是否为纯净物,某同学取10g样品和足量的水进行实验,共收集到氧气0.96g。请通过计算判断是否为纯净物______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com