
| 实验步骤 | 实验现象 | 实验结论 |
| 另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液. | ①只产生白色沉淀 | 该样品为b处溶液. |
| ②先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知溶液中的阳离子有Ca2+、H+ |
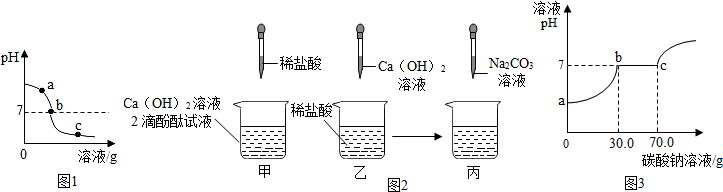
分析 (1)根据溶液的pH变化情况来分析;
(2)考虑酸碱中和生成盐和水,根据反应原理来书写;
(3)根据溶液的酸碱性以及碳酸钠的化学性质来分析.物质之间发生化学反应时,可能恰好完全反应,也可能有的反应物有剩余;合理设计实验,通过实验现象可以判断物质的组成情况.
(4)①根据盐酸和氢氧化钙的反应进行分析;
②反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算;
解答 解:(1)由图象可知,该溶液的pH由大到小,说明是向碱溶液中滴加酸,故填:稀盐酸;
(2)因为氢氧化钙与稀盐酸反应生成氯化钙和水;故其化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)【探究过程】
①根据图可知:a处的溶液显碱性,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象;故填:溶液由无色变成红色;
②根据图可知:b处溶液为氢氧化钙与稀盐酸恰好反应,生成氯化钙中性溶液;而c处的溶液显酸性,溶液中的溶质是氯化钙和氯化氢,其中的阳离子是钙离子和氢离子,溶液显酸性,加入碳酸钠后,先与稀盐酸反应生成二氧化碳气体,当盐酸完全反应后再与氯化钙反应生成白色沉淀;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+ |
| 实验步骤 | 实验现象 | 实验结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+. |
点评 本题考查了碱的化学性质,学生应熟悉碱的通性,并能利用信息结合碱的性质来解决问题,(1)中反应与图象相结合,明确图象中曲线的变化是解答的关键.


 优学名师名题系列答案
优学名师名题系列答案科目:初中化学 来源: 题型:选择题
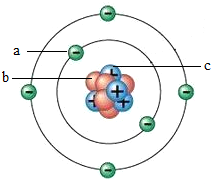 图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )| A. | 决定该原子种类的粒子是b | B. | 原子中b与c的数目一定相同 | ||
| C. | 原子中a与c的数目一定相同 | D. | 原子的质量集中在a和c上 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
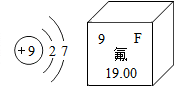 某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )
某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )| A. | 该元素的名称为F | |
| B. | 该元素的原子序数为9 | |
| C. | 该元素的相对原子质量为19 | |
| D. | 该元素原子在化学反应中容易失去电子变为阳离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
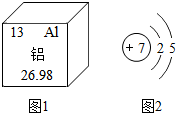 铝元素与人类关系密切.
铝元素与人类关系密切.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com