
 如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:
如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
分析 (1)根据溶解度的概念进行分析填空;
(2)根据在40℃时,KNO3和KCl溶解度的大小进行分析;
(3)根据饱和溶液与不饱和溶液之间的转化关系分析;
(4)根据KNO3的溶解度与饱和溶液中溶质的质量分数分析计算.
解答 解:(1)40℃时氯化钾(KCl)的溶解度为40克,表示在40℃时,氯化钾在100g水里达到饱和时溶解的质量是40g,
故填:在40℃时,氯化钾在100g水里达到饱和时溶解的质量是40g.
(2)由溶解度可知,在40℃时,KNO3的溶解度是63.9g,KCl的溶解度是40.0g,由乙烧杯的溶质全部溶解了,说明了乙烧杯中的溶质是KNO3;
故填:KNO3;
(3)A、当升高温度时,烧杯中的剩余固体全部溶解,溶液变为不饱和溶液,溶剂质量不变.故A说法正确;
B、如果通过加水使其全部溶解,溶质质量分数减小,故B错;
C、又溶解了一部分溶质,所以溶质质量分数增大,故C正确;
D、使其全部溶解可以升高温度或加入溶剂,故D正确.
故填:ACD;
(4)设饱和KNO3的溶液溶质质量分数为20%时的KNO3的溶解度是x
$\frac{x}{100g+x}$×100%=40% 解得:x=66.67g
由KNO3的溶解度可知,在50℃时,KNO3的溶解度是85.5g.所以,若要得到溶质质量分数为40%以上的KNO3溶液,配制时的温度应不低于50℃.
故填:50.
点评 解答本题关键是知道控制变量法设计实验的思想,知道方程式的书写方法,溶质质量分数的计算方法.


科目:初中化学 来源: 题型:实验探究题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
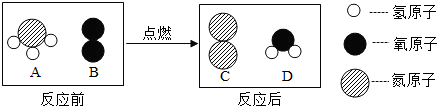
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
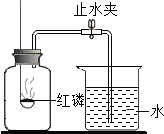 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是反应慢. | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | 二氧化锰加入水中不产生氧气 | |
| 实验三 | 向盛有5mL5%的过氧化氢溶液的试管中,加入二氧化锰,伸入带火星的木条 | 大量气泡产生,带火星的木条迅速复燃 | 二氧化锰能加快过氧化氢的分解 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KClO3中Cl的化合价为+6价 | B. | NH3中N的化合价为-3价 | ||
| C. | CO2中C的化合价为+2价 | D. | H2O、H2O2中O的化合价都是-2价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com