D
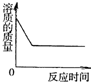
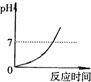
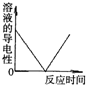
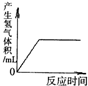
分析:根据金属与酸的反应进行分析,盐酸呈酸性,其pH小于7,足量的酸与镁反应后剩余溶液呈酸性,生成一定量的氢气后体积不再改变,溶液中含有能够自由移动的离子,导电性不会为零,参加反应的氯化氢质量为73,生成的氯化镁的质量为95,溶液质量会增加.
解答:A、根据常见反应的质量关系和质量守恒定律可得,每24份质量的镁反应后的溶液的质量=原来盐酸的质量+2镁的质量(即24份质量)-反应生成的氢气的质量(即2份质量);由此可见,反应后溶液质量是一定会增加的,故A错误;
B、盐酸呈酸性,其pH小于7,足量的酸与镁反应后剩余溶液呈酸性,不会出现pH大于等于7的情况,故B错误;
C、整个反应过程中溶液中含有能够自由移动的离子,反应前是氯离子和氢离子,反应中会消耗氢离子生成镁离子,所以该反应中溶液的导电性不会为零,故C错误;
D、镁与盐酸反应生成氢气,氢气的质量会不断变大,等镁全部参加反应,氢气质量不在改变,故D正确.
故选D.
点评:本题考查了金属与酸反应的有关知识,完成此题,可以依据已有的知识结合题干提供的信息进行.