
����Ŀ��ij��ȤС���ͬѧΧ����LNG����ʹ�õĽ������Ͻ������о���
���Ķ���˼������1���ں��Ӳ���ֹܵ�ʱ��ͨ��Ҫʹ���������������������Ϊ����Ļ�ѧ���� ��
��2�������ں�ˮ�������ⸯʴ���촬��ҵΪ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ������Ƕ����һ�ֽ��������øý��������Ļ�ԵIJ�ͬ�����������ױ���ʴ��

���о�����1��һ������£����ֻ�Բ�ͬ�Ľ����ڳ�ʪ�Ļ����нӴ�ʱ�����ֽ����ȱ���ʴ�أ�
��ʵ�����1������ĥ��Ľ���Ƭ������ͼ1��ʾ��ʵ�飬����һ��ʱ��۲쵽�������������±���
���� | ���� |
���У���Ƭ������ֻҰ�ɫ���ʣ���Ƭ���漸��û���������� | �������ڳ�ʪ�Ļ����нӴ��� ���ȱ���ʴ�� |
���У���Ƭ������� ��ͭƬ���漸��û���������� | ����ͭ�ڳ�ʪ�Ļ����нӴ��������ȱ���ʴ�� |
���ó����ۡ�һ������£����ֻ�Բ�ͬ�Ľ����ڳ�ʪ�Ļ����нӴ�ʱ����Խ� �ǿ�����������Ľ������ȱ���ʴ��
��֪ʶӦ�á��촬��ҵΪ�����ִ��ĸ�����DZ���ʴ��ͨ�����ִ������Ƕ�Ľ����� �����ţ���
A������ B��ͭ�� C������ D��п��
��3��LNG����ʹ���˴�����пͭ�Ͻ�
���о�����2���ⶨпͭ�Ͻ���ͭ����������
��ʵ�����2��������ͼ2��ʾ��ʵ�顣
��1��ͼ�������ܺ�ˮ�ܿ������������������Ϊȷ����������������ڶ�ȡ��������Һ������Ĺ����У�Ӧע�� �����ţ���
A������ʱ�����밼Һ����ʹ���ƽ
B������ǰӦ�����ƶ�ˮ�ܣ�������Һ����ƽ�ٶ���
C������ˮ�ܾ�ֹ����ˮ����Һ�治������ʱ�ٶ���
��2��ʵ��ǰ�����Ѿ���ĥ���Ŀ�״пͭ�Ͻ�ӹ�����м����Ŀ���ǣ� ��
��3��ʵ��������裺��������ԣ���ҩƷ��ˮװ��������У����Ӻ�װ�ú��ٴμ��װ�õ������ԣ���¼�����ܵ�Һ��λ��Ϊ5mL����A��B�μ������Լ�����B�в���������������ָ������º�¼�����ܵ�Һ��λ��Ϊ85mL����B��ʣ�������ˣ�ϴ�ӣ�����õ�����ƽ��������Ϊ0.416g��
�����ݴ�������ʵ�������£��������ܶ���0.09gL��1���������������ݼ���пͭ�Ͻ���ͭ������������
�����ڴ����д��������̣�
���𰸡���1���ȶ�
��ʵ�����1���� ����ɫ�Ĺ��� ���ó����ۡ�ǿ
��֪ʶӦ�á�D
��ʵ�����2����1��A B(2)�����ϡ����ĽӴ�������ӿ췴Ӧ�ٶ�
�����ݴ��������������������85-5=80�� mL����������������=0.08 L��0.09gL��1=0.0072 g
�⣺���ϡ���ᷴӦ�ĺϽ���п������Ϊx
Zn+H2SO4=ZnSO4+H2��
65 2
X 0.0072 g
65:2=x: 0.0072 g
X =0.234 g
�Ͻ������Ϊ0.234 g+0.416 g=0.65g
���ԺϽ���ͭ����������Ϊ0.416 g��0.65g��100%=64%
��пͭ�Ͻ���ͭ����������Ϊ64%
��������
�����������1������Ļ�ѧ�����ȶ���
��ʵ�����1����ͬ���������£���Ƭ������ֻҰ�ɫ���ʣ���Ƭ���漸��û�����Ա仯��˵���������ȱ���ʴ�����ڳ�ʪ�Ŀ������������⣬������һ�ֺ���ɫ���塣
���ó����ۡ������ĸ�ʴ�ǻ�ѧ�仯���������ԽǿԽ�ױ���ʴ��
��֪ʶӦ�á�����ͭ������п���ֽ�����ֻ��п�Ľ�����Ա���ǿ������ѡD.
��ʵ�����2����1�� A.����ʱ����Ҫ�밼Һ�����ʹ�����ˮƽ��B.��������Ĵ�С��ѹǿ��Ӱ�죬�������������Ӧ����һ��������ѹ������������ˮ���������ͨ�����Ե���������ˮ��Һ����ƽʱ��ѹǿ�ŵ���һ��������ѹ����ʱ����������ȷ�ġ�C. ˮ����Һ�治������ʱ��ֻ��ʾ��Ӧ�Ѿ�ֹͣ����ʱ�������ڵ�Һ�����ˮ���ڵ�Һ�棬�����������ڵ�ѹǿ����ˮ���ڵ�ѹǿ����ʱ�����������������һ��������ѹ�µ��������һ��������ѹ�����ƫ��������Ӧ��ѡAB����2����Ӧ��֮��Ӵ����Խ��ӦԽ��֡���Ӧ�ٶ�Խ�졣
��3�����������������85-5=80�� mL����������������=0.08 L��0.09gL��1=0.0072 g
�⣺���ϡ���ᷴӦ�ĺϽ���п������ΪX
Zn+H2SO4=ZnSO4+H2��
65 2
X 0.0072 g
65:2=x: 0.0072 g
X =0.234 g
�Ͻ������Ϊ0.234 g+0.416 g=0.65g
���ԺϽ���ͭ����������Ϊ0.416 g��0.65g��100%=64%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��Ԫ����Eu���Ǽ��⼰ԭ����Ӧ�õ���Ҫ���ϣ���֪�Ȼ���Ļ�ѧʽΪEuCl3����������Ļ�ѧʽΪ�� ��
A��Eu2O3 B��EuO C��Eu3O2 D��EuO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӧ������12��7��18ʱ������������ȾԤ���ȼ��ɳ�ɫ����Ϊ��ɫ����Ϣ����ȫ����12��8��7ʱ��12��10��12ʱ��������������Ⱦ��ɫԤ����ʩ����Ҳ�DZ����״�������������Ⱦ��ɫԤ��������������������������

A�����Ŷ������������ٿ�˽�ҳ�
B��Ϊ�˼�СPM2.5�Ի�����Ӱ�죬ֹͣ������ͥ��ů
C����������Ŵ�N95רҵ���֣����˿���0.1�����ң�
D��ֲ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��п��ϡ������ȡ�����������巢��װ���м���һ����п������30gϡ��������μ��룬ÿ������������������±���
���� | ��һ�� | �ڶ��� | ������ |
����ϡ��������/g | 10 | 10 | 10 |
������������/g | 0.04 | 0.04 | 0.02 |
��1�����Ƶ����� g��
��2������ϡ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҳ��õ�ʵ��������װ�ã�������ѧ֪ʶ�ش��������⣺

��1������a�������� ��
��2��ʵ������Aװ����ȡ�����Ļ�ѧ����ʽ�� ��Ϊ���Aװ�õ������ԣ�����װ�����¶Ȳ��䣬�����ܵ�ĩ������װ��ˮ���ձ��С���װ�����������ã��ձ��ڵ����е�����Ȧ���֣��� ��
ѡ�� | A | B | C | D |
|
����Ŵ�ͼ |
|
|
|
|
Ҫ����ȫ��Ӧ��IJ������л���MnO2�����¢١��ܵIJ������裬����Ϊ��ȷ��˳���� ������ʾ��K2MnO4������ˮ��MnO2������ˮ��
��ϴ�� �ں�� �۹��� ���ܽ�
A���ܢۢ٢� B���ܢۢڢ� C���٢ڢܢ� D���٢ڢۢ�
��3��ʵ������ȡ������̼�Ļ�ѧ����ʽΪ ������װ�ÿ�ѡ �����ţ���
ʵ��ʱҪ������ʱ���Ʒ�Ӧ���л�ֹͣ����ͼ�з��ϸ������ķ���װ���� �����ţ�����ʹ��Ӧ��ʱֹͣ��ʵ������� ��

��4��ij��ѧ��ȤС����������ͼ��ʾװ�����о��������ʣ��������£�
![]()
���������ϵ�һ����ɫ��������ֽ��
��������ֽ�ϵ�A����һ����ɫ��̪��Һ��B����һ��Ũ��ˮ��
��Ѹ���ñ������ס�����۲�����
�ڱ������п��Թ۲쵽�������ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
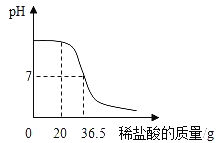
����Ŀ��ijУ��ѧС��������ϡ���������������Һ̽������кͷ�Ӧʱ���������ֻ�����������ձ�����ҺpH�ı仯ͼ������ͼ��ʾ������˵����ȷ����

A��ͼ��c����ʾ��Һ�ʼ���
B��ͼ��a����ʾ��Һ�У����е�������Na2SO4��H2SO4
C������ʵ���е�ϡ�����Ϊ������������������ͬ��ϡ���ᣬǡ����ȫ��Ӧʱ����ϡ��������С��ϡ����
D����a�㵽b���pH�仯����֤����ͼ�����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ������ܺ�̼���ơ������ơ��Ȼ��ء����ᱵ�����������е�һ�ֻ��֡�ij��ѧ��ȤС��Ϊ̽����ɷ���������ʵ�飺
��ȡ�����������ձ��У���ˮ�����Ͻ��裬�ձ��ڹ�������������ˮ�������ı仯��ͼ1��ʾ��
��ȡ����B��ʱ����Һ���Թ��У��μӷ�̪��Һ����̪��Һ����ɫ��
�������ձ��еμ�ϡ���Ტ���Ͻ��裬�ձ��ڹ�������������ϡ����������ı仯��ͼ2��ʾ��
��ش��������⣺
��1��д��һ������I�з�����Ӧ�Ļ�ѧ����ʽ��________________________
��2��BC�οɹ۲쵽��������________________________________________����C��DҺ���pH________�����������С�����䡱)
��3��ԭ��ɫ������һ������________________________�����ܺ���________________��
��4��D��ʱ����Һ��һ�����е�������________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������д����л�ѧ�� ������������������¡�ʳ��ס���еȸ������棬����ѧ���Ļ�ѧ֪ʶ����������⡣
��1������ʳ���и��������ʵ��� ������ĸ��ţ���ͬ��������ά���ص��� ��

��2���綯���г����䡰��㡢���������ص㣬��������������

�� �������г�����λ��ʹ�õIJ��ϣ������л��ϳɲ��ϵ��� ��
A������ֳ�Ȧ B�����ϳ��� C���ϳ�����̥ D���������⾵
���ڸ�����������Ϳ���ᣬ�ɷ�ֹ���⣬��ԭ���� ����ͭ�Ƶ�����Ҫ������ͭ�������õ� �ԡ�
��3����ͼ���ð��ײⶨ����������������һ�ַ�������ʵ��˵������Լռ����������� ��ͼ�зŴ�Ϊ����ȼ���ṩ�������� ��
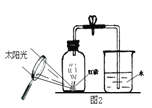
��4��������ն������������ЧӦ�ǵ��������������⡣�γ��������Ҫԭ���ǿ�������͵������������Ⱦ�����һ����˵�������Σ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ʵ��������һ����������������ϡ���ᣬ������ⶨij����������Һ�����ʵ�����������
ʵ��һ��37%��Ũ���ᣨ�ܶ�Ϊ1.19g/mL��������������Һ������ˮ����Ͳ��ϸ��ƿ��
ʵ�鲽�裺
��1�����㣺����74g��������Ϊ10%��ϡ���ᣬ��Ҫ37%��Ũ��������Ϊ mL����ȷ��0.1mL����ͬ������Ҫ����ˮ�����Ϊ mL��ˮ���ܶ�Ϊ1.0g/mL����
��2����ȡ������Ͳ�ֱ���ȡ��Ӧ��Ũ���������ˮ��
��3�� ��
��4��װƿ�����ϱ�ǩ��
ʵ��������������Ƶ�ϡ������뵽20gij����������Һ�У���ҺpH�ı仯�������ͼ��ʾ���Լ��������������Һ�����ʵ����������� ���ڴ����д��������̣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com