
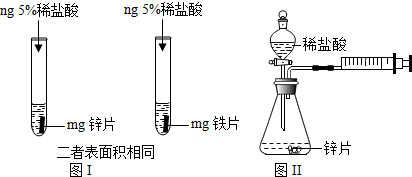
| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数 (均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1~2分钟 | 2~3 分钟 | 3~4分钟 | 4~5分钟 | 前5分钟共收集气体 | |||
| 1 | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| 2 | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
分析 【实验1】金属与酸的反应为置换反应,写出反应的化学方程式;根据现象得出结论;
【得出结论1】根据金属的活动性顺序,分析金属的活动性与反应的剧烈程度的关系;
【实验2】根据注射器的作用是量取生成气体的体积解答;
【得出结论2】根据表中信息结合浓度对反应的影响分析解答;
【反思评价】根据表中信反应的剧烈程度与酸的浓度有关,结合反应的过程进行分析;根据控制变量法分析影响反应速率的因素.
解答 解:【实验1】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式,铁与盐酸反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,因此金属活动性强弱为:Zn>Fe;
【得出结论1】金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
【实验2】注射器的作用是通过注射器往右移动的体积判断生成氢气的体积;
【得出结论2】根据表格信息可知,其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢;
金属与盐酸反应的剧烈程度可能受温度、金属的颗粒大小、金属的纯度等因素的影响,可以利用控制变量法设计实验;
故答案为:【实验1】Fe+2HCl=FeCl2+H2↑;>;
【得出结论1】金属活动性越强,反应的程度越剧烈;
【实验2】测量产生氢气的体积;
【得出结论2】盐酸的浓度越大,反应的程度越剧烈;
【反思评价】锌与盐酸发生反应产生气体的速率先快后慢;因为锌与盐酸反应是放热反应,所以随着温度升高,产生气体速率加快,随着反应的进行,盐酸不断被消耗,浓度降低,产生气体的速率变慢;金属表面积(或金属的形状或金属纯度或催化剂等).
点评 本考点主要考查了影响金属与酸发生化学反应速率的因素的探究,还考查了在生产、生活及实验中应注意的问题.从酸的浓度、金属的活动性和金属的状态等不同的角度,设计实验,也考查了学生的实验设计能力.要认真分析,综合把握,问题就会迎刃而解.本考点主要出现在实验题中.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
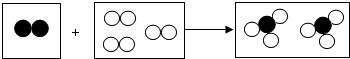 如图是某化学反应的微观模型,“○”“
如图是某化学反应的微观模型,“○”“ ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )| A. | 该反应属于分解反应 | |
| B. | 反应物和生成物中只有一种单质 | |
| C. | 参加反应的两种物质分子个数之比为2:3 | |
| D. | 反应中共有两种元素参与 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化合物是由不同元素组成的纯净物,所以只含一种元素的物质一定不是化合物 | |
| B. | 物质世界是由一百多种元素组成,因此可以利用周期表中的元素任意组合新物质 | |
| C. | 单质是由一种元素组成的纯净物,由一种元素组成的物质一定是单质 | |
| D. | 混合物由多种分子组成,多种分子组成的物质不一定是混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 分类 | 举例 |
| A | 常见合金 | 生铁、不锈钢、青铜 |
| B | 常见酸 | 盐酸、硫酸、醋酸 |
| C | 常见碱 | 熟石灰 纯碱 氨水 |
| D | 常见干燥剂 | 浓硫酸、生石灰、烧碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化汞加热分解HgO=Hg+O2↑ | |
| B. | 硫在氧气中燃烧S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | |
| C. | 铁在氧气中燃烧:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe2O3↑ | |
| D. | 氯酸钾和二氧化锰混合加热制氧气2KClO3$\frac{\underline{\;MnO_2\;}}{\;}$2KCl+3O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaSO4、NaOH、HCl | B. | AgNO3、HCl、KNO3 | ||
| C. | CuSO4、KCl、H2SO4 | D. | Na2CO3、NaCl、Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com