
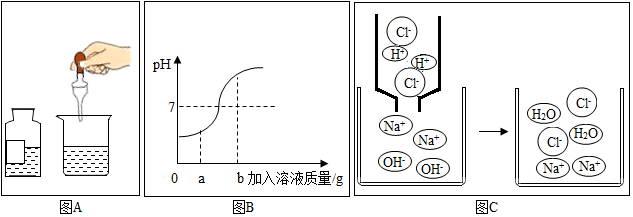
分析 (1)根据坐标变化的趋势结合盐酸的pH小于7,氢氧化钠溶液的pH大于7分析;
(2)当加入溶液的质量为ag时,溶液呈现碱性,溶液中既有生成的氯化钠,又有未反应的氢氧化钠;
(3)根据当溶液的pH=7时,酸碱恰好完全反应解答;
(4)当加入溶液的质量为bg时,溶液显碱性;
(5)根据中和反应的实质是酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程,即中和反应的实质是H++OH-=H2O.
(6)根据氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数解答.
解答 解:(1)坐标的pH变化是由大于7到小于7的过渡,因此进行的操作是将稀盐酸滴加到氢氧化钠溶液中.故填:稀盐酸;
(2)当加入溶液的质量为ag时,溶液呈现碱性,所得溶液中的溶质为氢氧化钠和氯化钠,故填:NaCl、NaOH;
(3)当溶液的pH=7时,酸碱恰好完全反应,溶液中的主要离子是钠离子和氯离子;故填:Na+、Cl-;
(4)当加入溶液的质量为bg时,所得溶液显酸性,所得溶液中的溶质为氯化氢和氯化钠,向所得溶液中滴加紫色石蕊试液,溶液呈红色;故填:红;
(5)中和反应的实质是酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程,即中和反应的实质是H++OH-=H2O;故填:H+、OH-.
(6)设HCl的质量为x,氢氧化钠的质量为40g×10%=4g
NaOH+HCl=NaCl+H2O
40 36.5
4g x
$\frac{40}{4g}=\frac{36.5}{x}$
x=3.65g
实验中所用稀盐酸中溶质的质量分数是$\frac{3.65g}{40g}×$100%=9.125%
答案:实验中所用稀盐酸中溶质的质量分数是9.125%
点评 解答本题的关键是根据坐标的pH变化结合溶液的酸碱性与溶液pH的关系进行分析,并对反应过程中的溶液的酸碱性正确判断.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 27.6% | B. | 41.2% | C. | 53.8% | D. | 58.3% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 用途 | 化学原理(用化学方程式表示) |
| A | 镁粉用于制照明弹 | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO |
| B | 稀硫酸用于除铁锈 | Fe+H2SO4═FeSO4+H2↑ |
| C | 氢氧化铝用于治疗胃酸过多 | Al(OH)3+3HCl═AlCl3+3H2O |
| D | 天然气用作燃料 | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com