
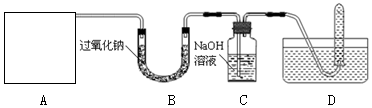
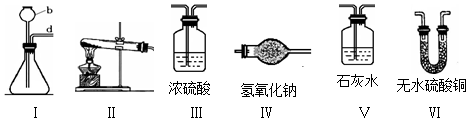
分析 (1)①根据实验室常用仪器的名称和题中所指仪器的主要进行分析;
②根据实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,浓硫酸具有吸水性进行分析;
(2)根据二氧化碳和氢氧化钠反应生成碳酸钠和水,氢氧化钠溶液可以吸收二氧化碳气体,而氢氧化钙溶液是鉴别二氧化碳气体的进行分析;
(3)根据无水硫酸铜遇水变蓝色,氢氧化钠和二氧化碳反应生成碳酸钙沉淀和水进行分析.
解答 解:(1)①通过分析题中所指仪器的主要可知,b是长颈漏斗,d是导管;
②实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,浓硫酸具有吸水性,所以A是实验室制取、干燥二氧化碳气体的装置应分别选用I、III;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O,如果没有氢氧化钠溶液吸收二氧化碳气体,所以D收集的气体除了氧气,还有二氧化碳气体;
(3)水和过氧化钠反应生成氢氧化钠和氧气,无水硫酸铜遇水变蓝色,氢氧化钠和二氧化碳反应生成碳酸钙沉淀和水,所以为确保收集的气体更纯净,可在A与B之间添加装置Ⅵ,在C与D之间添加装置Ⅴ,若实验要成功,刚刚添加的两个装置中的实验现象依次应该是:无水硫酸铜不变色、澄清石灰水不变浑浊.
故答案为:(1)①长颈漏斗,导管;
②I、III;
(2)2NaOH+CO2=Na2CO3+H2O,影响氧气的检验;
(3)Ⅵ,Ⅴ,无水硫酸铜不变色、澄清石灰水不变浑浊.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
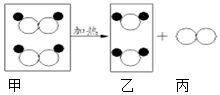 如图是某反应的微观示意图,若
如图是某反应的微观示意图,若  表示氧原子,
表示氧原子, 表示氢原子,有关说法不正确的是( )
表示氢原子,有关说法不正确的是( )| A. | 该反应前后分子种类、原子种类均没有改变 | |
| B. | 该反应前后原子的数目没有改变 | |
| C. | 该反应属于分解反应 | |
| D. | 图中甲、乙、丙三种物质均是由分子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
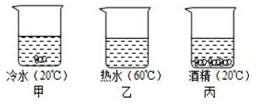
| 温度/℃ | 0 | 20 | 40 | 50 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 145 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑦ | C. | ②④⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
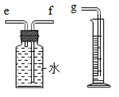 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去铁粉中含有的少量铜粉 | 将混合固体加入到足量稀盐酸中,充分反应后过滤、洗涤、干燥 |
| B | 鉴别①CuSO4溶液②稀H2SO4③NaCl溶液④NaOH溶液 | 不用其它任何试剂就能鉴别,且鉴别的顺序为①④②③或①④③② |
| C | 除去CO2中的少量HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| D | 比较Fe、Cu、Al的金属活动性 | 铝丝浸入CuSO4溶液,铜丝浸入FeSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com