
分析 锌和稀硫酸反应生成硫酸锌和氢气,根据氢气的质量可以计算锌的质量和硫酸中硫酸的质量,进一步可以计算该黄铜样品中铜的质量分数和原稀硫酸溶液中溶质的质量分数.
解答 解:(1)设锌的质量为x,硫酸的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 98 2
x y 0.4g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.4g}$,
x=13g,y=19.6g,
该黄铜样品中铜的质量分数为:$\frac{32.5g-13g}{32.5g}$×100%=60%,
答:该黄铜样品中铜的质量分数为60%.
(2)原稀硫酸溶液中溶质的质量分数为:$\frac{19.6g}{200g}$×100%=9.8%,
答:原稀硫酸溶液中溶质的质量分数为9.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
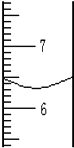 用量筒量取一定体积液体时,液面如图所示,该液体的体积是6.3mL.所用到的仪器的有量筒和胶头滴管.读取量筒内液体体积时视线应跟凹液面的最低处保持相平.若仰视,读数会<实际值;(填“<、>或=”)若俯视,读数会>实际值;(填“<、>或=”)
用量筒量取一定体积液体时,液面如图所示,该液体的体积是6.3mL.所用到的仪器的有量筒和胶头滴管.读取量筒内液体体积时视线应跟凹液面的最低处保持相平.若仰视,读数会<实际值;(填“<、>或=”)若俯视,读数会>实际值;(填“<、>或=”)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究
菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +6 | B. | +4 | C. | +2 | D. | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com