



 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:



查看答案和解析>>
科目:初中化学 来源:山东省中考真题 题型:实验题
反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。
【知识回顾】
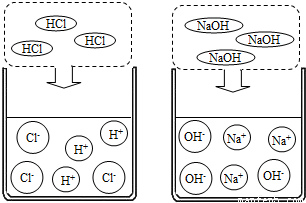
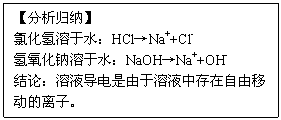
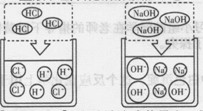
1.氯化氢气体、氢氧化钠固体不导电。
2.盐酸、氢氧化钠溶液能导电





 有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,
有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,查看答案和解析>>
科目:初中化学 来源: 题型:
反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。
【知识回顾】
1.氯化氢气体、氢氧化钠固体不导电。
2.盐酸、氢氧化钠溶液能导电
【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4→________。
【探索发现】
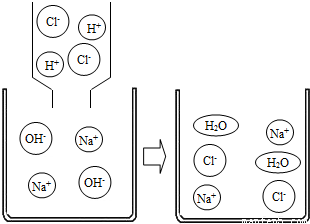
(1)氢氧化钠溶液与盐酸反应的微观示意图
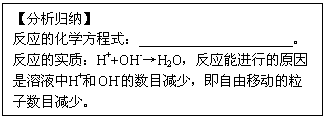
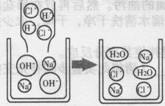
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图

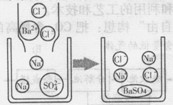
(提示:生成硫酸钡白色沉淀)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++CO32-→________________。
【总结规律】
上述复分解反应能发生的本质原因____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。
【知识回顾】
1.氯化氢气体、氢氧化钠固体不导电。
2.盐酸、氢氧化钠溶液能导电


【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4→________。
【探索发现】
(1)氢氧化钠溶液与盐酸反应的微观示意图


(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图


(提示:生成硫酸钡白色沉淀)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++CO32-→________________。
【总结规律】上述复分解反应能发生的本质原因____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。
【知识回顾】
1.氯化氢气体、氢氧化钠固体不导电。
2.盐酸、氢氧化钠溶液能导电


【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4→________。
【探索发现】
(1)氢氧化钠溶液与盐酸反应的微观示意图


(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图


(提示:生成硫酸钡白色沉淀)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++CO32-→________________。
【总结规律】
上述复分解反应能发生的本质原因____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com