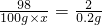现有10g不纯的锌(杂质不与酸反应)与100g稀硫酸恰好完全反应,反应后烧杯中剩余物质的总质量为109.8g.
(1)根据质量守恒定律,计算出产生H2的质量为(填写计算式):________;
(1)根据生成的0.2g氢气,计算所用稀硫酸中溶质的质量分数.
10g+100g-109.8g=0.2g
分析:(1)锌与稀硫酸反应会生成氢气,反应前后质量变化即为氢气的质量.
(2)根据氢气求出反应的硫酸质量,再利用硫酸溶液的质量即可求出硫酸中溶质的质量分数.
解答:(1)由质量守恒定律可知生成的氢气的质量=10g+100g-109.8g=0.2g
(2)设所用稀硫酸中溶质的质量分数为x
Zn+H
2SO
4=ZnSO
4+H
2↑
98 2
100g×x 0.2g
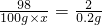
x=9.8%
答:所用稀硫酸中溶质的质量分数为9.8%;
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成氢气的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.