
分析 铜锌混合物遇到足量硫酸时,只有锌和硫酸反应生成了硫酸锌和氢气,所以导致烧杯内总质量减少的原因就是生成的氢气所致,所以生成的氢气的质量为前后的质量差值.根据氢气的质量和对应的反应方程式求算锌的质量进而求算混合物中锌的质量分数.
解答 解:根据质量守恒定律可知,生成氢气的质量为反应前后的质量差,即氢气的质量为0.4g
设生成0.4g氢气消耗的锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
$\frac{65}{2}$=$\frac{x}{0.4g}$
x=13g
所以混合物中锌的质量分数为$\frac{13g}{15g}$×100%≈86.7%
答:混合物中锌的质量分数为86.7%
点评 前后前后总质量有变化时应该是过程有气体生成或者有气体参与反应,根据对应气体的质量和对应化学方程式计算需要求算的物质的质量.注意要正确使用化学方程式以及准确使用对应数据,注意过程的完整性.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:初中化学 来源: 题型:填空题
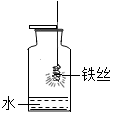 如图是铁丝在氧气中燃烧的实验,回答下列问题:
如图是铁丝在氧气中燃烧的实验,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
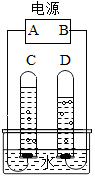 如图是简易电解水装置图,试回答问题:
如图是简易电解水装置图,试回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 8.5g | B. | 10.5g | C. | 11.5g | D. | 9.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室用H2O2 溶液和MnO2固体混合物制取O2,回答下列问题:
实验室用H2O2 溶液和MnO2固体混合物制取O2,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com