
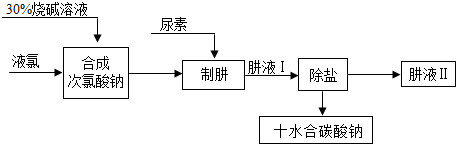
分析 (1)根据配制溶液需要的玻璃仪器考虑;
(2)根据方程式的书写和相对分子质量的计算考虑;
(3)根据碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法;
(4)根据方程式的写法考虑.
解答 解:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择:BD;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160;
(3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤,所以步骤为:BED;
(4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以化学方程式是:N2H4+O2=N2+2H2O.
故答案为:(1)BD;
(2)Cl2+2NaOH=NaCl+NaClO+H2O,160;
(3)BED;
(4)N2H4+O2=N2+2H2O.
点评 解答本题关键是要熟悉方程式的书写注意事项,知道配制溶液需要的仪器,溶质从溶液中结晶析出的方法.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去氯化亚铁溶液中的氯化铜 | 加入过量的锌粉,过滤 |
| B | 除去铜粉中的铁粉 | 加入过量的稀盐酸,过滤 |
| C | 除去CO2中的CO | 将气体点燃 |
| D | 除去NaCl中的少量Na2CO3 | 溶解、加热浓缩、降温结晶、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
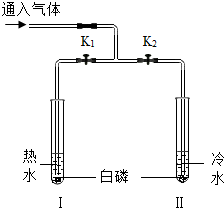 依据如图装置进行实验.
依据如图装置进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 无法比较 | B. | A=B | C. | A<B | D. | A>B |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
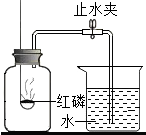 如图所示装置可用来测定空气中氧气的含量.下列说法中不正确的是( )
如图所示装置可用来测定空气中氧气的含量.下列说法中不正确的是( )| A. | 实验时红磷要过量 | |
| B. | 可用木炭替代红磷进行实验 | |
| C. | 要等到充分冷却后才能打开止水夹 | |
| D. | 该实验证明空气中氧气的含量约占$\frac{1}{5}$体积. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com