
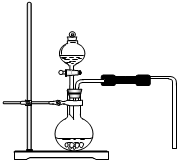
 在实验室常用加热高锰酸钾或分解过氧化氢的方法制取氧气,回答下列问题:
在实验室常用加热高锰酸钾或分解过氧化氢的方法制取氧气,回答下列问题:分析 ①根据气体的发生装置是由反应物的状态和反应条件决定的进行分析;
②根据过氧化氢在二氧化锰的催化作用下生成水和氧气进行分析;
根据题中导气管口向下,说明该方法是向上排空气法收集氧气,实验室还可以用排水法收集,原因是氧气不易溶于水进行分析;
③根据氧气有助燃性进行分析;
④根据分液漏斗可以控制液体的滴加速度进行分析;
⑤根据氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,依据质量守恒定律求出氧气质量,在依据化学方程式计算氯酸钾的质量.
解答 解:①气体的发生装置是由反应物的状态和反应条件决定的;
②过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
题中导气管口向下,说明该方法是向上排空气法收集氧气,实验室还可以用排水法收集,原因是氧气不易溶于水;
③氧气有助燃性,所以该方法收集的氧气是否已满用带火星的木条证明,若出现木条复燃,证明氧气已收集满;
④分液漏斗可以控制液体的滴加速度,所以烧瓶中反应剧烈,应采用的措施是:减慢过氧化氢溶液的滴加速度;
⑤生成氧气的质量为:8g-5.6g=2.4g,设需要氯酸钾的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 2.4g
$\frac{245}{x}$=$\frac{96}{2.4g}$
x=6.125g
所以二氧化锰的质量分数为:$\frac{8g-6.125g}{8g}$×100%=23.4%.
故答案为:①反应物的状态,反应条件;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
向上排空气法,排水法,氧气不易溶于水;
③带火星的木条,木条复燃;
④减慢过氧化氢溶液的滴加速度;
⑤6.125g,23.4%.
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.


科目:初中化学 来源: 题型:选择题
| A. | 干燥制取的氧气 | B. | 增加产生氧气的体积 | ||
| C. | 没有什么作用,可以不放 | D. | 作为催化剂,加快反应速率 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
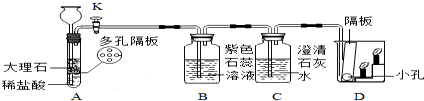
| A. | B处现象说明二氧化碳能使紫色石蕊变红 | |
| B. | C出溶液变浑浊,是因为生成了不溶于水的碳酸钙 | |
| C. | D处的实验现象是下层蜡烛先熄灭,上层蜡烛后熄灭 | |
| D. | D处现象说明二氧化碳不可燃,不助燃,密度比空气大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2MnO4 KMnO4 MnO2 MnCl2 ( Mn元素 ) | |
| B. | KCl Cl2Ca(ClO)2 KClO3 NH4ClO4 ( Cl 元素 ) | |
| C. | Na2SO4 Na2SO3 S Na2S ( S 元素 ) | |
| D. | N2O5 N2O NH3 HNO3 (NH4)2SO4 ( N 元素 ) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
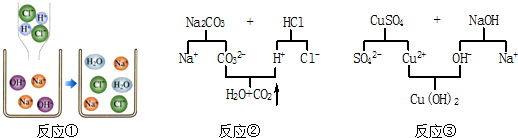
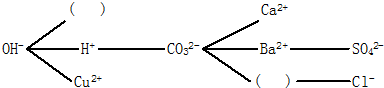
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com