
【题目】下列图像能正确反映对应变化关系的是

A. 20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体
B. 将等质量的镁片和铁片投入到足量稀硫酸中
C. 用酒精灯加热一定量的高锰酸钾固体
D. 向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液
【答案】A
【解析】试题分析:解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答,A、20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体,刚开始会溶解直至达到饱和状态,故溶质质量分数先变大后不变,正确,B、将等质量的镁片和铁片投入到足量稀硫酸中,由于金属的活动性:Mg>Fe,故反应速率也应该是Mg>Fe,故反应所需时间是Mg<Fe,错误,C、用酒精灯加热一定量的高锰酸钾固体,由于产生了氧气,使得剩余固体质量减少,而根据质量守恒定律,锰元素的质量不变,故锰元素的质量分数应增大,直至反应结束后不变,错误,D、向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液,由于横坐标表示的是过氧化氢溶液的质量,故产生的氧气应随着过氧化氢溶液的质量增大而增大,错误,故选A


科目:初中化学 来源: 题型:
【题目】为测定Na2CO3样品是否纯净,某同学称取11.4g样品放入烧杯中,向烧杯中加入73g稀盐酸.恰好完全反应后烧杯中剩余的总质量为80g(假设产生的气体全部逸出)(计算结果精确到0.1%).
(1)反应生成气体的质量为 g.
(2)样品中碳酸钠的质量是多少?
(3)所取稀盐酸中溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔。
海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如上表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
①海水从密度为1.21g/ml浓缩到1.22g/ml时下列说法正确的是___________
A.各种盐的溶解度增大
B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大
D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是__________。
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如下图:
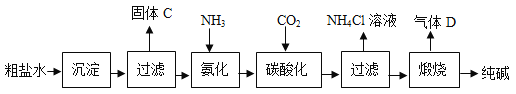
已知:ⅰ常温下,NH3极易溶于水,CO2能溶于水;
ⅱNaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
①粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为__________;
②流程中,先“氨化”后“碳酸化”的目的是__________;
③“碳酸化”后过滤获得的NH4Cl可用作__________肥,也可先__________(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是__________;
④“煅烧”时,NaHCO3分解生成的气体D是__________,若将气体D直接排入空气不合理的理由是__________。
(3)海滨研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:

请回答下列问题:
①操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、__________。
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式__________。
③操作Ⅱ酸化时应选择的酸是__________(填写化学式)。
④上述反应中未涉及的基本反应类型是__________(填写字母)。
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
⑤回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为__________。紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时甲烷产量最高是__________(填写“①”、“②”、或“③”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活离不开化学,用所学化学知识回答下列问题:
(1)日常生活中食用的鸡蛋、脱脂奶中富含的营养素是_______。为了防止佝偻病及发育不良,幼儿青少年可以补充一些含________元素的食品。
(2)下列主要用有机合成材料制成的是_________。(填标号)
A.羊毛衫 B.涤纶连衣裙 C.纯棉T恤
(3)正常人的胃液中含有约0.5%的盐酸。某种胃药中含有Al(OH)3,能治疗胃酸过多的疾病。服药后发生的化学反应方程式为____,该反应属于____(填写基本反应类型)。
(4)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有___________的功能.
(5)A、B两种物质是初中阶段常见化合物,由相同元素组成且A的相对分子质量比B大。
① 若A、B均为气体,且A、B可以互相转化,则A→B的化学方程式为___________
② 若A、B两种液体均能转化为气体C,则C的化学式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化石燃料的燃烧、硫酸的生产都产生二氧化硫,被雨水吸收后会形成酸雨,使农作物、建筑物等遭到破坏。工业烟气通常含有二氧化硫,在排放前需经脱硫处理.如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略).请回答下列问题:

(1)CaSO3中Ca、S、O元素的质量比是_______________.
(2)已知原料NaOH的价格为5.8元/kg、Ca(OH)2的价格为0.74元/kg.两种工艺中,处理相同质量的SO2,_____________所需的原料成本更低(填“双碱法”或“钠碱法”)。
(3)环保部门能较为精确测定某硫酸厂周围空气中二氧化硫的含量。取空气样品1000m3缓缓通过足量氯水(化学方程式:SO2+Cl2+2H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生的白色沉淀质量为2.33g。试回答:
①通过测定雨水的_________来粗略判断其是否为酸雨。
②配制氯化钡溶液时,需用到的主要玻璃仪器有烧杯、量筒和_________。
③我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示,请通过计算说明此空气中二氧化硫的浓度级别。
浓度限值(mg/m3) | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0.70 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通常用的食醋中含有3%-5%的乙酸(化学式C2H4O2),有关乙酸的说法正确的是
A.乙酸是一种氧化物
B.6g乙酸中含有2.4g碳元素
C.乙酸的相对分子质量为60g
D.一个乙酸分子中含有2个碳原子、4个氢原子、1个氧分子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有水的烧杯中加入少量品红,品红在静置的的水中扩散。从分子的角度对此现象的正确解释是
A.分子是不断运动的 B.分子是可分的
C.品红分子发生变化 D.分子体积很小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~E是初中常见的物质:氢氧化钠、盐酸、氢氧化钙、碳酸钠、二氧化碳中的某一种.A可用于金属表面除锈,B可用来改良酸性土壤,固体C在空气中易潮解。它们相互间发生反应或转化的关系如图所示(“﹣”表面两种物质间能发生反应,“→”表示两种物质间的转化关系)。
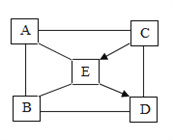
(1)A、C的化学式分别为 ____________ 、______________;D在生活和生产中的一种用途是_____________ ;
(2)E→D反应的化学方程式为___________________;
C与D反应的化学方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com