
����Ŀ�������г������ʵ����ʡ��Ʒ��ǻ�ѧ�о�����Ҫ���ݡ�
��1�����ֽⷴӦ������������_____��
��2��m������������һ������ϡ����ǡ����ȫ��Ӧ�������õ���������������ȥ�к���ͬ��ϡ���ᣬ����Һ��pH_____7��������ڡ����ڻ�С�ڣ�
��3���������Ƴ��ڷŵ������л���ʣ���д���������Ʊ��ʵĻ�ѧ��Ӧ����ʽ_____��
��4����ͼװ�ÿ���һ����̼��ԭ��������ʵ�顣
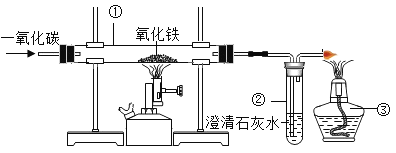
��Ӳ���Թܢ��е�ʵ������Ϊ_____��
�ڸ�ʵ���з������Ϸ�Ӧ�Ļ�ѧ����ʽΪ_____��
�۹�ҵ���ø�¯�����������¯�м�������ʯ����̿��ʯ��ʯ�������������������ô��¯����ʱ��̿������Ϊ��_____��_____
��5����ʵ���ҳ�ȡ20g��������Ʒ�����ձ��У����ʲ��μӷ�Ӧ��������100g������������Ϊ21.9%�����ᣬ����ǡ����ȫ��Ӧ���Լ�����Ʒ������������������_____��
���𰸡���Ӧ��������ӽ���������ˮ�������������Ҹ�Ԫ�صĻ��ϼ۲��� �� CO2��2NaOH=Na2CO3��H2O ����ɫ������ɫ 2CO��O2![]() 2CO2 ̼ȼ��ʱ�����������ȣ�Ϊ��Ӧ�ṩ�������� ̼���������̼���巴Ӧ�������л�ԭ�Ե�����һ����̼�����ڻ�ԭ������ 80%
2CO2 ̼ȼ��ʱ�����������ȣ�Ϊ��Ӧ�ṩ�������� ̼���������̼���巴Ӧ�������л�ԭ�Ե�����һ����̼�����ڻ�ԭ������ 80%
��������
��1�����ֽⷴӦ�����������ǣ���������������ۣ���Ӧ��������ӽ���������ˮ�������������Ҹ�Ԫ�صĻ��ϼ۲��䣻
��2��80���������������ƺ�73�������Ȼ���ǡ����ȫ��Ӧ��74���������������ƺ�73�������Ȼ���ǡ����ȫ��Ӧ��m������������һ������ϡ����ǡ����ȫ��Ӧ�������õ���������������ȥ�к���ͬ��ϡ���ᣬ����Һ�л�ʣ�����������ӣ���Һ�Լ��ԣ�pH��7��
��3���������Ƴ��ڷŵ������л���ʣ����������������̼��Ӧ����̼���ƺ�ˮ��ѧ��Ӧ����ʽ��CO2��2NaOH=Na2CO3��H2O��
��4��
��Ӳ���Թܢ���һ����̼�����������������·�Ӧ�������Ͷ�����̼���壬��ʵ������Ϊ����ɫ������ɫ��
�ڸ�ʵ����һ����̼��������ȼ�ղ���������̼�Ļ�ѧ����ʽΪ��2CO��O2![]() 2CO2���÷�Ӧ���ϡ����һ�����ڻ��Ϸ�Ӧ��
2CO2���÷�Ӧ���ϡ����һ�����ڻ��Ϸ�Ӧ��
�۹�ҵ���ø�¯�����������¯�м�������ʯ����̿��ʯ��ʯ�������������������ô��¯����ʱ��̿������Ϊ��1��̼ȼ��ʱ�����������ȣ�Ϊ��Ӧ�ṩ����������2��̼���������̼���巴Ӧ�������л�ԭ�Ե�����һ����̼�����ڻ�ԭ��������
��5���⣺����Ʒ��������������Ϊx��

![]() x=16g
x=16g
��Ʒ������������������=![]() ��
��


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ��(C16H18O9)����Ϊ��������Ӫ���ء����ɴ����ֽϹ�Ķ���(��ҩ��)����ȡ�������й���ԭ���˵���У�����ȷ����()
A.һ����ԭ������к���43��ԭ��
B.��ԭ��������������
C.��ԭ����̼Ԫ���������������Ԫ������������С
D.��ԭ���ˮ��Һ�У�����Ԫ��������Ϊ1:8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧǰ����������Ԫ�ػ��ϼ۷����仯�ķ�Ӧ��������ԭ��Ӧ�����뻯ѧ��Ӧ�������ͼ�Ĺ�ϵ��ͼ��ʾ������ʾ���д�����ǣ�������
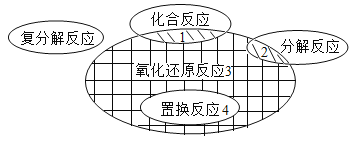
A.��Ӱ1��CO2+H2O�TH2CO3
B.��Ӱ2��2H2O![]() 2H2��+O2��
2H2��+O2��
C.��Ӱ3��Na2CO3+BaCl2=BaCO3��+2NaCl
D.��Ӱ4��Fe+CuSO4�TFeSO4+Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ������������벻����Դ��
��1��ú��ʯ�ͺ���Ȼ���dz����Ļ�ʯȼ�ϣ���Ȼ��ȼ�յĻ�ѧ����ʽΪ______��
��2����������������Դ�ǽ����Դ�������Ҫ;������������������Դ����_________��
A �������� B ̫������ˮ��
��3��ҳ�����г����о綾��H2S���壬����ʱ������й©��������������������Һ��H2S�γɵ���Һ������Ӧ����ѧ����ʽ�ɱ�ʾΪ![]() ����X�Ļ�ѧʽ��_________��
����X�Ļ�ѧʽ��_________��
��4����ҵ�ϳ���ú������ʹ����ȼ�գ���Ŀ����______��
A ����ú���˷�
B ��������������
C ���ٶ�����̼���ŷ�
D ����������γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�����й����ı仯������ȷ����
A.  һ�����������������Ƭ�еμ�����������
һ�����������������Ƭ�еμ�����������
B.  ��һ��������ϡ�����еμ�ˮ
��һ��������ϡ�����еμ�ˮ
C.  ���Ȼ���������Ļ����Һ�еμ�����������Һ������
���Ȼ���������Ļ����Һ�еμ�����������Һ������
D.  ��������һ��������ʯ��ʯ
��������һ��������ʯ��ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������۩��۩�������֮�佨����ϵ����ѧϰ��ѧ��һ����Ҫ��˼ά��ʽ����ͼ��Ԫ�����ڱ��в���Ԫ�ص�ԭ�ӽṹʾ��ͼ��������ѧ֪ʶ�ش����е����⣮
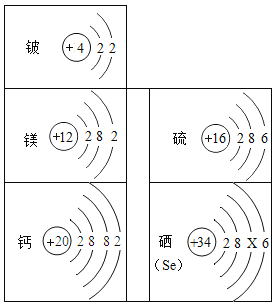
��1����ԭ�ӽṹʾ��ͼ�е�X=____����Ԫ������______�����������������ǽ�������Ԫ�أ�
��2��Ӳˮ�к��еĽ�������Ϊ________�������ӷ��ţ���
��3����Ԫ�غ���Ԫ�صĻ�ѧ�������ƣ���������Ļ�ѧʽΪ________��
��4����Է����������״���µ��������֮����ڽ��ܵĹ�ϵ�����±����������±��жϣ���״����22.4L����������YΪ______��������±����ɳ�һ�����ɣ�______��
���� | ���� | ���� | |
��Է������� | 2 | 32 | 28 |
��״���£�22.4L��������� | 2g | 32g | Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ�������������ɵ�ij����������ʵ�����������ȡ100g�û���ᣬ��εμ�ijBa(OH)2��Һ�����ɳ���BaSO4��������pH�ı仯��ϵ��ͼ1��ʾ��
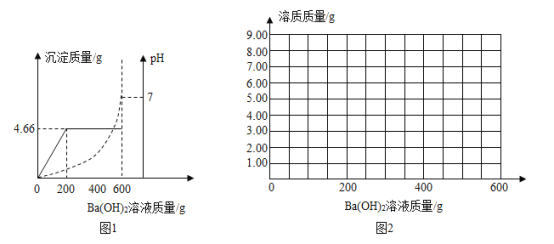
��1�������������������ҺΪ______gʱ�������ǡ�ñ��кͣ�
��2����Ba(OH)2��Һ�е��������������Ƕ��٣�_____��д��������̣������ȷ��0��01%��
��3���������������������______���������ȷ��0.01%��
��4������ͼ2�л�����100g�û�����м���600g Ba(OH)2��Һ�Ĺ����У�������У��������ʵ����������ӵ�Ba(OH)2��Һ��������ϵͼ��_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1��һЩ�������ʵ�ת����ϵ������C����ɫ�̼��Ե����壬����ʹ����ʯ��ˮ����ǣ�E��һ������Ⱦ�������Դ����ȼ�ղ�����H2O��
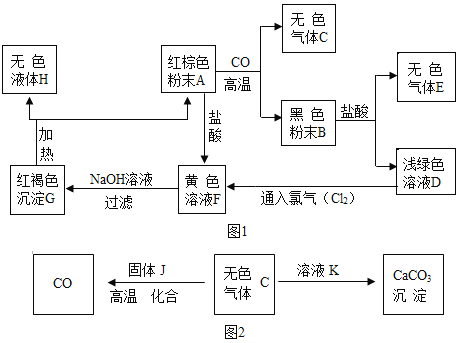
�������ͼ1���ش������й����⣺
(1)Gת��ΪH��A�ķ�Ӧ������______��Ӧ��
(2)��A�����ᷴӦ�Ļ�ѧ����ʽΪ��___����D��������������F�Ļ�ѧ����ʽΪ__��
(3)����ͼ1����ɫ����CΪ���ģ���չ��ͼ2����д��ʵ��������ת������һ��Ӧ��J��K�Ļ�ѧʽ��J______��K______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ұ���������������в�����һ�����ĺ�ͭ���ϡ���ѧ��ȤС������ϡ��������۷������ͭ������������������塣����Ʒ�����ͼ��ʾ��
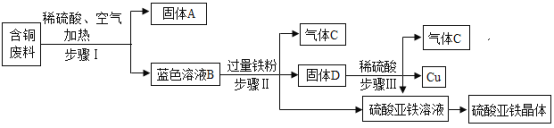
�������ϵ�֪����ͨ����������ȵ������£�ͭ����ϡ���ᷴӦת��Ϊ����ͭ����Ӧ�Ļ�ѧ����ʽ:![]() ��
��
(1)����I�з���õ�����A����ɫ��ҺB�IJ���������_______________��
(2)��ɫ��ҺB�е�������______________ (�ѧʽ)������D�ijɷ���_______________��
(3)д��������з�����Ӧ�Ļ�ѧ����ʽ_______________������������Һ�п��ܺ��е�������_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com