
分析 (1)利用溶质质量=溶液质量×溶液的溶质质量分数,计算每天要处理的废酸中硫酸的质量;
(2)根据反应的化学方程式,根据硫酸的质量计算需要氢氧化钠的质量;
(3)根据反应的化学方程式,判断使用氢氧化钙时氢氧化钙与硫酸的质量的比,与使用氢氧化钠反应时进行对比,判断每天需要两种碱的质量大小关系.
解答 解:(1)每天要处理的废酸液中含有H2SO4的质量=1×106g×0.49%=4900g;
故答案为:4900;
(2)设每天需要NaOH的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O,
80 98
x 4900g
$\frac{80}{x}=\frac{98}{4900g}$
x=4000g
故答案为:4000;
(3)Ca(OH)2+H2SO4=CaSO4+2H2O,
74 98
可见消耗相同质量的硫酸,需要氢氧化钙的质量小于需要氢氧化钠的质量.
故答案为:小于.
点评 利用反应的化学方程式可以表示反应中各物质的质量的关系,可根据一种物质的质量而求得反应中其它物质的质量.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:初中化学 来源: 题型:解答题
 20℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示的斜线,回答下列问题:
20℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示的斜线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
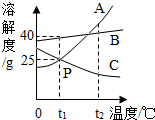 如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水):
如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水):查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应:
已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com