
����Ŀ����10�֣���������Ҫ�ɷ�ΪFeS2�����ʲ�����Ԫ�أ����ҹ���������᳧��ȡ�������Ҫԭ�ϡ���ѧ����С��Ϊ�ⶨij��������FeS2�������������µ�ʵ��̽��������ÿ����Ӧ����ȫ����
���������ϡ���4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��Na2SO3+H2O2��Na2SO4+H2O
��ʵ��̽����
��. ��ȡ1.60 g��������Ʒ������ͼ��ʾװ�ã��гֺͼ���װ��ʡ�ԣ���ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����Ӧ��ȫ��
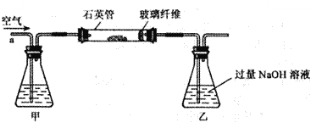
��. ��Ӧ��������ƿ�е���Һ�������´�����
���������ۡ�
��1������װ���м�ƿ��ʢ�ŵ��Լ�������������Һ���������� ��
�������ⶨ��
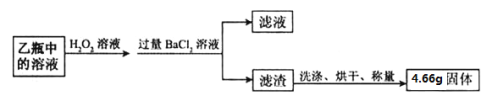
��2���������յõ���4.66g������ �������ʵ����ƻ�ѧʽ����
��3������û�������FeS2����������������д��������̣�
��������˼��
��4�����ȱ�ټ�װ�ã������ղ��FeS2�������������� ���ƫ��ƫС�����䡱����
��5������֤������BaCl2��Һ�����ķ����� ��
����չӦ�á�
��ҵ���Ի�����Ϊԭ����������Ĺ�������ͼ������ʾ��
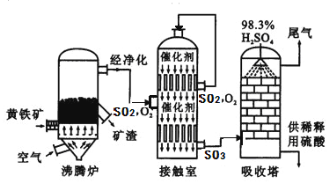
��6���Ӵ����з�����Ӧ�Ļ�ѧ����ʽΪ ����ѧʵ����������������Ϊ98%��Ũ���ᣬ����ʵ���г���Ҫ�õ���ϡ�����ᡣҪ��100g����Ũ����ϡ�ͳ���������Ϊ10%�����ᣬ��Ҫˮ�������� g��������һ����Ҫ�Ļ�����Ʒ����;ʮ�ֹ㷺����д��ϡ�����һ����; ��
��7��������������Ĺ�������ͼ������˵����ȷ���� ������ĸ����
A��Ϊʹ��������ȼ�գ��轫�����
B�������ܹ����SO2�ķ�Ӧ���ʺͲ���
C��SO2����Ϊ���������ԭ��ѭ��������
D������¯�ų��Ŀ����ɹ�����
���𰸡���1�����տ����еĶ�����̼��2��BaSO4 ��3��75% ��4��ƫ��
��5��ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ���������
��6��2SO2+O2![]() 2SO3 880 ȥ������ ��7��ACD
2SO3 880 ȥ������ ��7��ACD
��������
�������������װ���м�ƿ��ʢ�ŵ��Լ�������������Һ�������������տ����еĶ�����̼�������Ķ������������ں�������ķ�Ӧ�в����������ƣ������ƺͼ�����Ȼ�����Ӧ�����ˢ������յõ���4.66g������BaSO4����Ԫ�ص�������4.66g��32/233=0.64g FeS2��������0.64g/64/120=1.2g 1.2g/1.6g��100%=75%�����ȱ�ټ�װ�ã������ղ��FeS2��������������ƫ����Ϊ�����л���̼�ᱵ������֤������BaCl2��Һ�����ķ�����ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ����������Ӵ����з�����Ӧ�Ļ�ѧ����ʽΪ��������������ķ�Ӧ��������������Ĺ��̣�ϡ�����һ����;ȥ������ȣ�������������Ĺ�������ͼ��Ϊʹ��������ȼ�գ��轫����飻SO2����Ϊ���������ԭ��ѭ�������ã�����¯�ų��Ŀ����ɹ�������������ȷ�ġ�����Ҫ��ˮX����100=��100��+X����10% X=880��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯һ�����ڻ�ѧ�仯����
A��ֲ�������� B���ɱ�����
C���û���̿��ȥ���� D��ʪ�·�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4�֣��������˳���������Ϳ�ѧ�о�������ҪӦ�á���ش��������⣺
��1��������ʿ��������2009��3��26������Բ����ʧ������������ͭ������Բ�������˺����й�����ĸ��飬�ȫ�й������ǿ�ҷ��ԡ��û�ѧ֪ʶ������������ͭ����150���꣬�����൱��ö�û��������ʴ��ԭ����_______________________��
��2������2008���˻����Ϊ������ֱ��Ϊ70 mm����6mm��ʵ����ѧ��ѧ��ȤС��Խ����н����ijɷ�������룺����Ϊ�ý������ɽ����Ͻ��Ƴɣ�����Ϊ�ý������ɻ�ͭ(ͭп�Ͻ�)�Ƴɡ�Ϊ����֤���ǵIJ��룬����ȡ�������ֽ��ƵIJ��ʷ�ĩ��������ʵ�飬�����Լ�����֤���ס��Ҳ���������______��
A������ͭ��Һ B������ C������п D����������Һ
��3��ʵ����ѧ�о�С�����ö����ķ�������Al��Fe �ֱ���ϡ���ᷴӦ�� ���������Ƚ�Al��Fe������Ե�ǿ��������˼�ͼ��ʾ��װ��(ʵ���в��ñ������ͬ����˿����˿)��
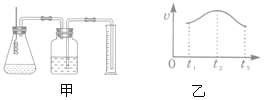
��ʵ��ʱ������ɰֽ��ȥ��˿����˿���������������
����Ҫ�Ƚϼ�ͼ�в�������Ŀ��������Բ�����ͬʱ���ڲ�������������Ҳ���Բ���_______________��
��ʵ������˿�������������(V)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ����t1��t2ʱ���ڷ�Ӧ�����ӿ����Ҫԭ����________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����9�֣���ͼ��ȼ����ʾ��ͼ��

��1����ͼ��ȼ�����ͼƬ��ͼƬ�к��е��л��ϳɲ����� _ _ ����ȼ����Ļ�����ֻ�ɫ���ɫ�����׳��ֺ�ɫ����ԭ����_ _ __����ʱ����Ҫ___ _ ___�������С������ߵĽ���ڡ�
��2��������ͼ�ֱ��ʾ1kg��ͬȼ��ȼ�ղ���CO2��SO2��������
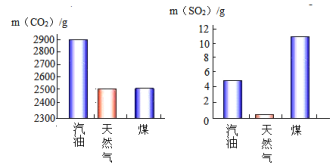
�����н�����ȼ����____ __ __��ʹ��____ ___��ȼ��ʱ�����γ����ꡣ
�ڼ����������������̼���ŷţ����Խ�������̼����ת������ͼΪ�÷�Ӧ����ʾ��ͼ������ͼʾ�ش��������⡣
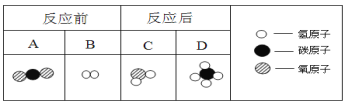
����4���������������������__ ������ĸ��ţ����÷�Ӧ��A��C�������ʵ��������� ��
��3����ͼ����ˮ���ӵ��ģ��ͼ�����������غ㶨�ɿ��жϸ�ģ��ͼ��ȱ���� ��
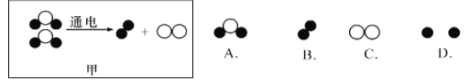
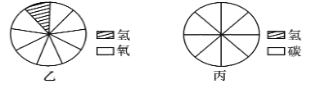
��ͼ�ұ�ʾˮ�и�Ԫ����������ģ�ͣ���ģ�¸�ͼ����ͼ���н������飨CH4���и�Ԫ����������ģ�͡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ѧѧϰ��ͬѧ�Ƕ����ʵ���ɺͽṹ����һ�����˽⡣
��1������H��C��O��Na����Ԫ�أ���ѡ�����е�Ԫ��д���������ʵĻ�ѧʽ:
����Ȼ������Ҫ�ɷ� ��������ú���ж�����Ҫ���� ��
��ʵ���ҳ��õ��ܼ� �����決������÷��ͷ���Ҫ�ɷ� ��
��2���������裨SiO2���������������Ĥ��������Ĥ����������������̼����ˮ���գ�����ͼ��ת��Ϊ�������ʵ�̼����泥�NH4HCO3����
��NH4HCO3�� ��Ԫ����ɡ�
��SiO2�й�Ԫ�صĻ��ϼ�Ϊ ��
�����ֶ�����̼��ѧ���ʵ���С������ ��������������ƣ���
�������ӵĽṹʾ��ͼΪ![]() ����X= ��
����X= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӳ������ɽ���������þ��ͭ���̵ȡ���֪����˿����ϡ�����У������ݲ�������˿������������Һ�У�����û�н��������������йؽ����Ļ��ǿ���жϴ������
A��Mnǿ��Cu B��Alǿ��Mn C��Mgǿ��Al D��Mnǿ��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
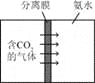
����Ŀ����ͼ�Ǽס������ֹ�����ܽ�����ߡ�����˵���д������
A��t1��ʱ��50 gˮ������ܽ�15 g��
B��t2��ʱ���ס��ұ�����Һ�����ʵ���������һ�����
C����ȥ�����������������ʿɲ�ȡ���½ᾧ�ķ���
D�����ס���������Һ���¶ȴ�t2�潵�� t1��ʱ�����������������һ���������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������ӵ�˵����ȷ����
A��ֻ�������ܹ�������
B������֮���м����ԭ��֮��û�м��
C�����Ӻ�ԭ�Ӷ��ڲ�ͣ�˶�
D�����Ӻ�ԭ���ڻ�ѧ�仯�ж��ܹ��ٷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�еļס��ҡ�����ʾ���л�ѧ���������ʣ��Ҽס��ҡ���Ϊ��ͬ���Ļ���������������θҺ�к��������ļף��ɰ���������ͼ�С�������ʾ���˵����ʼ��ܷ�����ѧ��Ӧ����������ʾ���ʼ����ת����ϵ�����ַ�Ӧ���������ȥ��

��1��д���Ļ�ѧʽ ��
��2���������ڳ�����ΪҺ�壬�������������������������ҵĻ�ѧʽΪ �����Ļ�ѧʽΪ ��
�������ڳ�����Ϊ���壬�ҿ��ɼ������ʯ��Ӧ�õ������ҵĻ�ѧʽΪ ����������б��������ֽⷴӦ���仯ѧ����ʽΪ ��д��һ�����ɣ���
��д�����е��Һ͢��е��ҷ������Ϸ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com