
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是
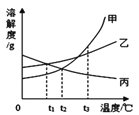
A. t2℃时,甲、丙两溶液中溶质的质量分数相等
B. 甲物质中混有少量乙物质,可用降温结晶的方法提纯甲
C. t3℃时,甲、乙、丙三种饱和溶液恒温蒸发等质量的水,则析出固体(不含水)的质量:甲>乙>丙
D. t3℃时,甲、乙两种饱和溶液降温到t2℃时析出固体的质量:甲>乙
科目:初中化学 来源: 题型:
【题目】现有100g 8%的NaOH溶液,请按下面要求计算:
(1)该溶液的pH_______7(选填“>”“=”或“<”)。
(2)若用该溶液吸收CO2,最多可以生成Na2CO3________?(写出详细计算过程)
(3)当NaOH全部转化成后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O =2NaHCO3,直至Na2CO3完全反应完。请在下图画出利用100g 8%的NaOH溶液吸收CO2直至生成NaHCO3的曲线。
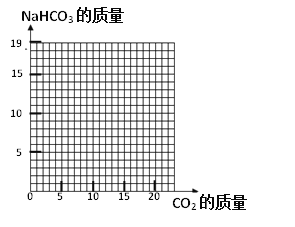 ________________
________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是工业上制取硫酸的催化剂,如图是制取V2O5的工艺流程
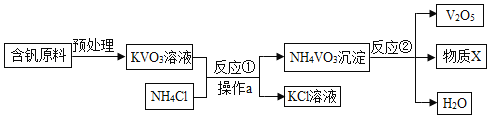
(1)操作a的名称是_____,该操作中玻璃棒起的作用是_____
(2)反应②的反应类型是_____反应,V2O5中钒的化合价是_____,物质X中一定含有的元素是_____
(3)工业上利用SO2与O2在加热并用V2O5作催化剂的条件下转化为SO3,再用SO3与水反应制取硫酸,请写出SO2转化为SO3的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图。请回答:

(1)钠元素的相对原子质量是_____;氯元素的质子数为_____。
(2)D、F形成化合物的化学式是_____。
(3)与元素的化学性质关系最密切的是_____(填写序号)。
A 原子的核外电子数 B 元素的相对原子质量 C 原子的最外层电子数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
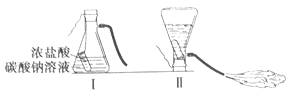
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。下面是对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
(探究一)硫酸的性质
(1)探究浓硫酸的某些特性。
①用小木棍蘸取少量浓硫酸,放置一会后,可观察到___。
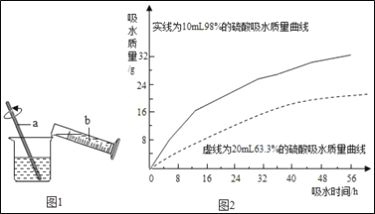
②浓硫酸的稀释:浓硫酸稀释过程如图1所示,b中盛放的物质是___,a的作用是___。
③兴趣小组把98%的浓硫酸10ml和63.3%的硫酸溶液约20mL分别放入两个相同的小烧杯中,称量、观察、记录、分析,根据室温环境下实验的数据绘成的曲线如图2.由图2曲线你能得到的实验结论:_____(写两点)。
(2)探究稀硫酸的化学性质。
如图3将适量的稀硫酸分别加入A~E的五只烧杯中。
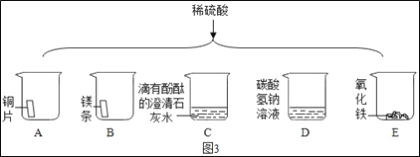
①有产生气泡的是___(填序号,下同);有白色沉淀生成的是___。
②能证明C中发生化学反应的现象是___。
(3)请写出稀硫酸的一种用途___。
(探究二)硫酸的工业制法。
工业上以黄铁矿为原料生产硫酸的工艺流程如图4所示。
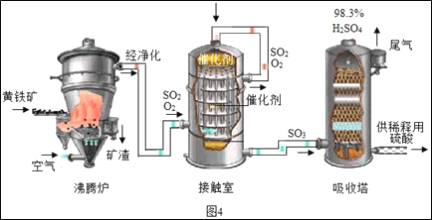
(1)接触室中发生的化学方程式为___。
(2)依据生产硫酸的工艺流程图,下列说法正确的是___(填字母序号)。
A 为使黄铁矿充分燃烧,需将其粉碎 B 催化剂能够提高SO2的反应速率和产量
C 吸收塔中得到的产品为混合物 D 沸腾炉排出的矿渣可供炼铁
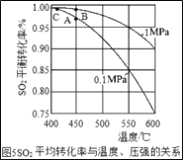
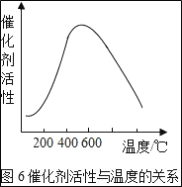
(3)接触室中的SO2平衡转化率与温度及压强的关系如图5所示。催化剂活性与温度的关系见图6.在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是___;___。
(探究三)探究某黄铁矿中FeS2的含量。
同学们进行了如下实验探究。
(查阅资料)①4FeS2 +11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3 +H2O2 =Na2SO4 +H2O
(实验探究)
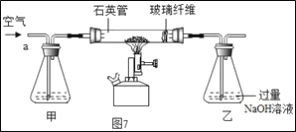
Ⅰ称取1.60g黄铁矿样品放入如图7所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应。
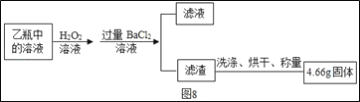
Ⅱ反应结束后,将乙瓶中的溶液进行如图8处理
(问题讨论)
(1)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是___;II中滤液所含的溶质一定有___。
(含量测定)
(2)II中最终得到的4.66g固体是___(填化学式)。
(3)计算该黄铁矿中FeS2的质量分数为___。(写出计算过程)
(交流反思)
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会___(填“偏大”“偏小”“不变”)
(5)如何证明II中所加BaCl2溶液已过量(请简要写出操作方法及现象)___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请在横线上用恰当的化学用语表示:
(1) 2 个二氧化碳分子: ______; (2)2Fe3+______;
(3)烧碱溶液中的阴离子: ______;
(4)请连线:______

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
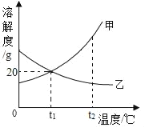
A. t1℃时,甲乙的溶解度相等,它们饱和溶液的溶质质量分数也相等,都为20%
B. t1℃时,30g甲加入到50g水中最多可得80g溶液
C. t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙
D. t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将等质量的a、b两种固体,分别加入到盛有lO0g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
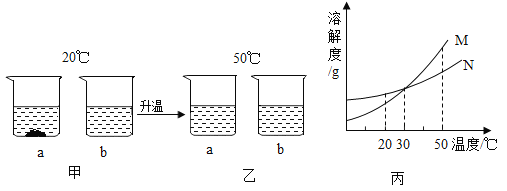
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com