
 (1)铜常用于制作导线,因为其具有良好的导电性.
(1)铜常用于制作导线,因为其具有良好的导电性.分析 (1)根据铜的性质和用途分析.
(2)根据纯铝和铝的硬度分析回答.
(3)根据防止铁生锈的原理分析回答;铝的密度较小,化学性质比较活泼,在通常情况下能被空气中的氧气氧化;金属资源属于不可再生资源,回收利用废旧金属具有重要意义.
(4)在金属活动性顺序中,排在前面的金属可以把位于它后面的金属从其盐溶液中置换出来,可简记为“前置后,盐可溶”.
解答 解:(1)铜常用于制作导线,因为其具有良好的导电性.
(2)将纯铝和铝合金相互刻画,纯铝上留下明显划痕,说明铝合金的硬度比纯铝的大.铝锅轻便、耐用的原因是铝的密度小,常温下,铝能够与氧气反应,从而在表面生成致密的氧化铝薄膜,阻止铝的进一步氧化.回收利用废旧金属的意义在于:可以减少环境污染,节约金属资源.
故填:减少环境污染,节约金属资源.
(3)对汽车部分钢铁部件进行喷漆可以防止其生锈,原因是隔绝空气和水.铝锅轻便、耐用的原因是铝的密度小,常温下,铝能够与氧气反应,从而在表面生成致密的氧化铝薄膜,阻止铝的进一步氧化.回收利用废旧金属的意义在于:可以减少环境污染,节约金属资源.
(4)在金属活动顺序表中,金属的活动性顺序是锌>铜>银.向一定量AgNO3溶液中加入铜和锌的混合粉末时,锌先与硝酸银反应,当锌反应完后,铜再与硝酸银反应.
①若乙中含有锌、铜、银三种固体,说明了溶液中没有硝酸银、硝酸铜,则溶液甲中所含的金属离子符号为:Zn2+,此时向固体乙中加入稀盐酸,锌能与发生反应,化学方程式为:Zn+2HCl═ZnCl2+H2↑,该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物,属于置换反应.
②若溶液甲显蓝色,说明了铜与硝酸银反应生成了硝酸铜,化学反应方程式为:Cu+2AgNO3═2Ag+Cu(NO3)2,此时固体乙中一定含有的物质是银.
故答为:
(1)导电性;
(2)铝合金的硬度比纯铝的大;
(3)隔绝空气和水;铝的密度小,常温下,铝能够与氧气反应,从而在表面生成致密的氧化铝薄膜,阻止铝的进一步氧化;减少环境污染,节约金属资源;
(4)①Zn2+,Zn+2HCl═ZnCl2+H2↑,置换;②Cu+2AgNO3═2Ag+Cu(NO3)2,银.
点评 本题主要考查物质的性质和用途,解答时应该理解物质的用途是由物质的哪种性质决定的;对于化学方程式的考查始终是中考的热点.


科目:初中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小红同学将浑浊的湖水样品倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问:
小红同学将浑浊的湖水样品倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问:查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 8.3g | B. | 7.7g | C. | 1.7g | D. | 2.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
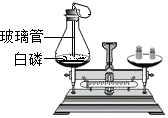 某班同学在做测定白磷燃烧前后质量变化情况实验,实验装置如下图.
某班同学在做测定白磷燃烧前后质量变化情况实验,实验装置如下图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③ | B. | ①②④⑧ | C. | ①②④⑤⑥⑧ | D. | 全部都是 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com