



 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:初中化学 来源:不详 题型:单选题
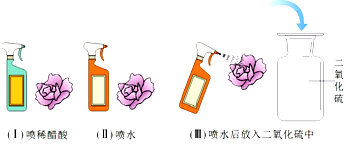
| 实验操作 | 实验现象 |
| | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| A.托盘天平 | B.烧杯 | C.漏斗 | D.量筒E.胶头滴管 |


查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
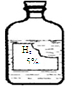
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取该液体适量于试管中,向其中加入少量 粉末。 | 没有气泡产生。 | 该液体不是过氧化氢溶液。 |
| 步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | | 该液体是稀硫酸。 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
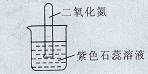
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

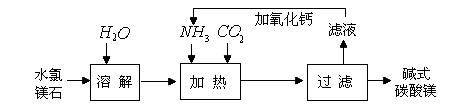


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com