学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入盛有NaOH溶液的烧杯中,并用温度计测量温度变化.

小军发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低.对此合理的解释是
盐酸和氢氧化钠溶液反应要放出热量,等反应完全后不再放热,
盐酸和氢氧化钠溶液反应要放出热量,等反应完全后不再放热,
而加入的盐酸会使溶液的温度降低
而加入的盐酸会使溶液的温度降低
;
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小雯同学在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌).
①通过实验现象,小雯排除了实验B,你认为她的理由是
石蕊遇碱变蓝,遇中性溶液变紫,而这两种颜色比较接近,现象不明显
石蕊遇碱变蓝,遇中性溶液变紫,而这两种颜色比较接近,现象不明显
;
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是
溶液变为红色,表明盐酸和氢氧化钠反应,但是滴加的氢氧化钠过量,不容易判断终点,所以该方案不合适
溶液变为红色,表明盐酸和氢氧化钠反应,但是滴加的氢氧化钠过量,不容易判断终点,所以该方案不合适
;
③实验时,老师告诉小雯:相对于实验A,实验D也有不足.通过下面的资料,你认为理由是
根据资料可以知道溶液只有达到弱碱性时石蕊才会变成紫色,而盐酸和氢氧化钠恰好完全反应时溶液呈中性,所以滴加的氢氧化钠溶液依然过量,所以该方案不合适
根据资料可以知道溶液只有达到弱碱性时石蕊才会变成紫色,而盐酸和氢氧化钠恰好完全反应时溶液呈中性,所以滴加的氢氧化钠溶液依然过量,所以该方案不合适
;
【资料卡片】:
紫色石蕊试液和无色酚酞试液在不同酸碱性溶液中的变色情况
| 紫色石蕊试液 |
pH<5.0:红色 |
5.0<pH<8.0:紫色 |
pH>8.0:蓝色 |
| 无色酚酞试液 |
pH<8.2:无色 |
8.2<pH<10.0:红色 |
pH>10.0:无色 |
④小杰认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由?
不正确;氢氧化钠也为白色固体
不正确;氢氧化钠也为白色固体
.
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度
>
>
100℃(填“>”、“<”或“=”);
②实验后溶液一定显碱性的试管有
4
4
支,实验3后溶液中NaOH质量分数
>
>
(填“>”、“<”或“=”)实验2后溶液中NaOH质量分数;
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识?
在温度较高的时候酚酞在碱性溶液中不会变红.
在温度较高的时候酚酞在碱性溶液中不会变红.
;
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是
氢氧化钠变质
氢氧化钠变质
.
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小江同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:
| 温度/°C |
10 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
64 |
85 |
138 |
203 |
285 |
376 |
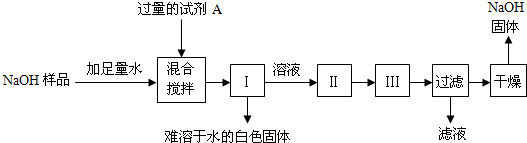
①试剂A是
Ca(OH)2
Ca(OH)2
(填化学式)溶液;
②操作名称:Ⅰ
过滤
过滤
、Ⅱ
蒸发
蒸发
、Ⅲ
降温结晶
降温结晶
;
③为获得纯度较高的NaOH固体,小江同学应在干燥前将其用
饱和的氢氧化钠溶液来洗涤所得晶体
饱和的氢氧化钠溶液来洗涤所得晶体
进行淋洗.
【探究五】:测定NaOH样品中NaOH的质量分数
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO
2被完全吸收).
求:①样品中NaOH的质量分数(精确到小数点后一位);
②在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确);解题过程:
①设混合物中碳酸钠的质量为x,消耗盐酸的质量为y
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
10673 44
xy?7.3%2.2g
==解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
×100%=60.7%
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:

①设混合物中碳酸钠的质量为x,消耗盐酸的质量为y
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
10673 44
xy?7.3%2.2g
==解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
×100%=60.7%
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:

;

【反思】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?
根据氢氧化钠变质的过程可以知道,氢氧化钠要先吸收水分潮解后然后才会和二氧化碳反应,所以13.5g样品中包含了水的质量,而计算时没有考虑到吸收的水的质量,故会使求得的氢氧化钠的质量分数偏大
根据氢氧化钠变质的过程可以知道,氢氧化钠要先吸收水分潮解后然后才会和二氧化碳反应,所以13.5g样品中包含了水的质量,而计算时没有考虑到吸收的水的质量,故会使求得的氢氧化钠的质量分数偏大
;
【拓展提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?
将氢氧化钠样品烘干后进行实验
将氢氧化钠样品烘干后进行实验
.

 金钥匙试卷系列答案
金钥匙试卷系列答案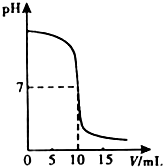 (2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.
(2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.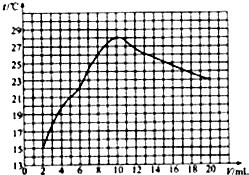
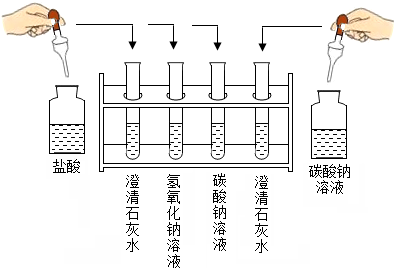 (2013?河西区一模)实验室产生的废液应尽量实现绿色排放(要求废液呈中性),而达到无害化处理.某兴趣小组的同学在进行如下图所示的实验之后,将废液收集在一个洁净的废液缸中,进行绿色排放.已知氯化钙溶液呈中性.
(2013?河西区一模)实验室产生的废液应尽量实现绿色排放(要求废液呈中性),而达到无害化处理.某兴趣小组的同学在进行如下图所示的实验之后,将废液收集在一个洁净的废液缸中,进行绿色排放.已知氯化钙溶液呈中性.