
| 氯酸钾的质量 | 催化剂的种类 | MnO2的质量 | 反应条件 | 收集45.0mL O2所需的时间(S) | |
| Ⅰ | 3.0g | MnO2 | 1.0g | 混合加热 | 21 |
| Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
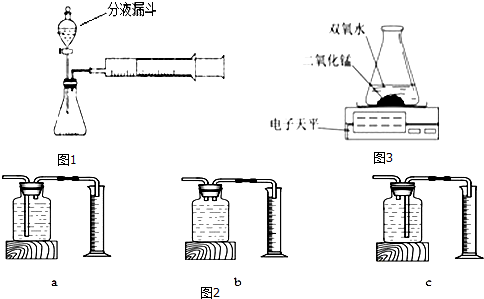
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 温度 | 相同时间(10S)内产生O2体积(mL) | |
| Ⅰ | 50.0g | 1% | 0.1g | 20℃ | 9 |
| Ⅱ | 50.0g | 2% | 0.1g | 20℃ | 16 |
| Ⅲ | 50.0g | 4% | 0.1g | 20℃ | 31 |
| 时间/S | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
分析 (1)根据控制变量的实验方法以及实验数据来分析;
(2)根据催化剂的概念以及化学方程式的写法来分析;
(3)根据装置的特点来分析其检查气密性的方法;
(4)测量氧气的体积采用的是排水法,将排出的水的用量筒收集起来,排出的水的体积就是氧气的体积;气体短管进长管出才能排出试剂瓶中的水,据此进行分析解答;根据表格数据来分析;
(5)在催化剂的作用下,过氧化氢会分解生成氧气;
(6)根据表格数据以及反应物的浓度变化来分析;
(7)温度对反应的速率也有影响.
解答 解:(1)控制氯酸钾的质量相等才能比较出二氧化锰和氧化铜的催化效果,所以也应该取3.0g氯酸钾;由表格数据可知,收集相同体积的氧气,加入二氧化锰的需要的时间较短;故填:3.0;快;
(2)在该反应中,二氧化锰作为催化剂,其质量与化学性质在反应前后均不改变,在二氧化锰的催化作用下,过氧化氢分解为水和氧气;故填:化学性质;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)气密性的检验是根据压强原理,可以关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,证明该装置的气密性良好;注射器可用来测量生成气体的体积;故填:注射器活塞回到原来位置;测量生成气体的体积;
(4)①测量氧气的体积采用的是排水法,将排出的水的用量筒收集起来,排出的水的体积就是氧气的体积;气体短管进长管出才能排出试剂瓶中的水,要将瓶内的水排出来,A和B都不可以,应该选择C装置作为实验装置.故填:C;
②由表格数据可知,在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快;故填:在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快;
(5)在催化剂的作用下,过氧化氢分解为水和氧气,气体逸出,装置质量减少,相同的时间内,质量减少的越多,反应速率越快;故填:相同时间天平读数差值大小(其它合理也可);
(6)由表格数据可知,在第36S时,气体的体积不再增加,说明反应已经结束;该反应是个放热反应,反应开始的过程中,反应物的浓度较大,且随着温度的升高,
反应速率较快,随着反应的进行,反应物的浓度减少,温度也在降低,反应的速率减慢了;故填:36;双氧水在二氧化锰作催化剂下分解反应是放热反应,使得开始时溶液温度升高,过氧化氢的分解速率加快.然后随着反应的不断进行,双氧水的浓度逐渐变小,过氧化氢的分解速率变慢.
(7)温度对化学反应的速率可能也有影响,所以可设计如下实验:分别取两份质量相等的二氧化锰放入两支试管中,然后分别加入体积和浓度相同,但温度不同的双氧水,比较其分解速率;故填:温度;分别取两份质量相等的二氧化锰放入两支试管中,然后分别加入体积和浓度相同,但温度不同的双氧水,比较其分解速率.
点评 本题考查的是影响过氧化氢分解速率的因素,难度不大,完成此类题时,分析问题要注意控制变量.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 碳的各种单质都是黑色的 | |
| B. | 小刚在家放一块煤在冰箱中除异味 | |
| C. | 小红在家用澄清石灰水保藏新鲜鸡蛋 | |
| D. | 李大伯在温室中喷洒CO2作肥料 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
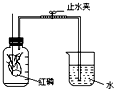 所示装置可用来测定空气中氧气的含量.对该实验认识不正确的是C
所示装置可用来测定空气中氧气的含量.对该实验认识不正确的是C查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由红色变为蓝色 | B. | 由蓝色变为红色 | C. | 由红色变为无色 | D. | 由无色变成红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 5.8g | B. | 8.4g | C. | 4.2g | D. | 4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com